Abstriche, Gewebeproben, Sputum, Spülflüssigkeiten und Lavage

Histopathologische bzw. zytologische Beurteilung
- Für die histopathologische Untersuchung werden Gewebeproben möglichst unverzüglich in gepufferte 4% Formalinlösung gegeben.
- Abstriche und Punktate (z.B. Schilddrüse) werden zur zytologischen Beurteilung auf einen Objektträger gegeben und luftgetrocknet oder mit einem Fixationsspray fixiert.
- Für die zytologische Beurteilung von Flüssigkeiten (Erguss, Punktat, Urin) ist eine Fixation in 50% Ethanol-Lösung oder 4% Formalin erforderlich.
Weitere Informationen zum Thema finden Sie unter: Pathologie im LADR Laborverbund
Abstriche
Für den kulturellen Erregernachweis werden Abstriche mit einem sterilen Tupfer durchgeführt, der in ein Transportmedium eingedrückt wird (sog. Geltupfer). Für molekulare Nachweismethoden (PCR) dürfen dagegen ausschließlich trockene Tupfer oder Tupfer mit Amies-Transportflüssigkeit verwendet werden. Weitere spezielle Entnahmeverfahren finden sich im A-Z-Teil bei den einzelnen Erregern.
Augen- und HNO-Abstriche
- Symptomgeleitete Diagnostik Augenerkrankungen
- Die Sekretentnahme sollte möglichst vor einer Anwendung von lokalen Desinfektionsmitteln, Anästhetika oder Antibiotika erfolgen, ggf. frühestens 4-6 h danach.
- Bei trockenen Entzündungsformen muss der Tupfer vorher mit steriler Kochsalzlösung angefeuchtet werden.
- Membranöse Beläge werden vorsichtig angehoben und das Sekret von der Unterseite entnommen.
- Für molekulare Nachweisverfahren sollten trockene Tupfer bzw. Tupfer mit Amies-Transportflüssigkeit verwendet werden.
- Bei Untersuchungen auf Chlamydien und Gonokokken ggf. Spezialbesteck verwenden.
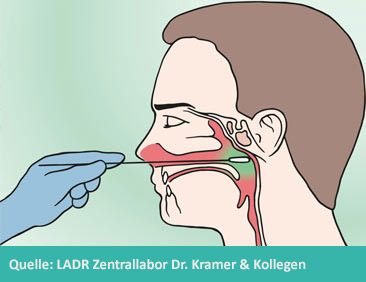
- Zum Nachweis spezieller Erreger (z.B. Bordetella pertussis, Sars-Cov-2) ist ein Nasopharyngealabstrich (siehe Abbildung) erforderlich.
Rachen-, Tonsillenabstriche
Zur Gewinnung von Abstrichmaterial wird die Zunge mit einem Spatel heruntergedrückt und Material von entzündeten bzw. sekretbedeckten Arealen des Rachens oder der Tonsillen entnommen. Dabei sollten die Wangenschleimhaut und die Zunge nicht berührt werden (Kontaminationsgefahr durch Standortflora).
- Zur Untersuchung auf Angina Plaut-Vincent sollte ein zusätzlicher Tupfer eingesendet und der Verdacht auf dem Anforderungsschein vermerkt werden.
- Für die Untersuchung auf Corynebacterium diphtheriae bitten wir um eine telefonische Ankündigung. Bitte unbedingt Meldepflicht bereits bei Verdacht beachten!
- Für den Nachweis von Bordetella pertussis wird ein Nasopharyngealabstrich benötigt.
Probentransport taggleich bei RT, sonst Zwischenlagerung bei 4 °C
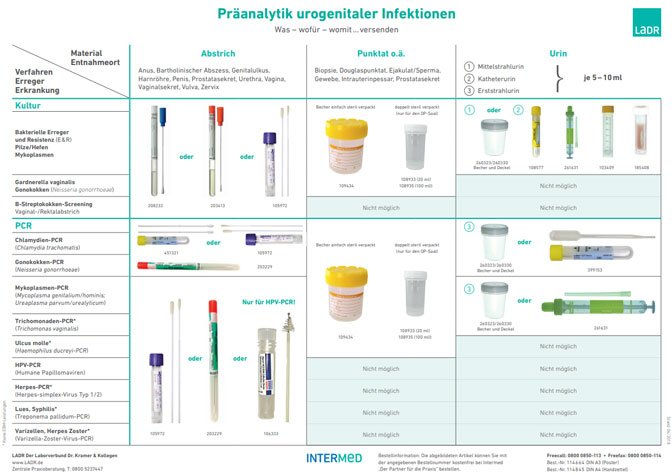
Vaginal-, Zervix-, Urethral-, Genitalabstriche, Sperma
Sekrete müssen sorgfältig gezielt aus dem Infektionsbereich gewonnen werden. Eine Kontamination mit der umliegenden Standortflora ist zu vermeiden.
- Urethralsekret wird mit dem Abstrichtupfer aufgenommen, indem nach vorsichtiger Reinigung mit sterilem Wasser oder steriler 0,9 %-Kochsalzlösung der Harnröhrenmündung die Harnröhre von proximal nach distal ausgestrichen wird. Erscheint kein Sekret, den Tupfer vorsichtig ca. 2 cm in die Urethra vorschieben und langsam drehen.
- Prostatasekret: Nach Reinigen der Harnröhrenmündung wird die Prostata vom Rektum aus massiert und das ausfließende Exprimat in einem sterilen Gefäß oder mit einem Abstrichtupfer aufgefangen.
- Zervix- und Vaginalsekret wird nach Spekulumeinstellung gezielt mit dem Abstrichtupfer entnommen.
Für viele Infektionserreger im Urogenitalsystem weisen molekulare Nachweisverfahren gegenüber den üblichen Kultur- oder Mikroskopie- Verfahren eine deutlich höhere Sensitivität (Gonokokken, Trichomonaden) auf. Für einige Erreger wie Mycoplasma genitalium und Chlamydia trachomatis ist der Nachweis mittels PCR die Methode der Wahl, da die Anzucht Zellkultur-Systeme voraussetzt, die in der Routine nicht mehr verwendet werden und darüber hinaus Wochen bis Monate benötigen würden. Weitere Details sind im Schaubild „Präanalytik urogenitaler Infektionen“ (DIN A4 Best.-Nr. 114845) dargestellt.
Zum Vergrößern Bild anklicken:
Probentransport taggleich bei Raumtemperatur, sonst Zwischenlagerung bei 4 °C
Eiter-, Wund-, Abszess-, Fistel-, Ulkus-, Haut-, Schleimhautabstriche
- Material aus geschlossenen Eiterungen sollte möglichst vor einer chirurgischen Eröffnung perkutan punktiert werden. Auch bei schleimhautnahen Prozessen ist die perkutane Punktion vorzuziehen. Erregerreiches Material wird vor allem in den Randbereichen von Eiterherden angetroffen.
- Bei offenen Wunden muss zuerst das oberflächliche, sekundär besiedelte Sekret mit einem sterilen Tupfer entfernt werden. Dann wird vom Grund und aus den Randbezirken der Wunde Material entnommen, am besten mittels Kanüle und Spritze, scharfem Löffel oder ähnlichem, sonst mittels Abstrichtupfer.
- Bei Fisteln ist zunächst das oberflächlich austretende Sekret zu entfernen und die Fistelöffnung mit 80 % Ethanol zu desinfizieren. Dann wird Material aus der Tiefe des Fistelganges entweder mit einem eingeführten dünnen Katheter aspiriert oder mit einer feinen Kürette herausgeschabt.
- Für eine mikrobiologische Untersuchung und Befundung müssen die Art des Materials, die genaue Lokalisation und der Entnah-mezeitpunkt angegeben werden. Reichlich gewonnenes, flüssiges Material nativ in sterilem Röhrchen einsenden (je mehr desto besser, um mehrere verschiedene Medien beimpfen zu können); geringere Mengen Sekret mit Abstrichtupfer aufnehmen und sofort in ein geeignetes Transportmedium geben.
Probentransport taggleich bei RT, sonst Zwischenlagerung bei ca. 4 °C
Gewebeproben
Gewebe werden in sterile Röhrchen gegeben, bei sehr kleiner Probe sollte ggf. 1 ml sterile NaCl-Lösung 0,9 % zugesetzt werden, damit das Material nicht eintrocknet und möglicherweise am Gefäßrand festklebt. Für den Nachweis von Helicobacter pylori sollte ein spezielles Transportröhrchen verwendet werden: Port-A-Germ Pylori (Best.- Nr. 105055).
Haut und Hautanhangsgebilde
bei V. a. Haut- / Nagelmykosen bzw. Skabies
- Die Entnahme von Hornschuppen zur mykologischen Diagnostik erfolgt aus den Randbereichen der erkrankten Haut. Nach Entfernen der lockeren Hautschuppen und gründlicher Reinigung werden Hornschuppen mit dem Skalpell abgeschabt und in ein steriles Röhrchen überführt.
- Haarstümpfe bzw. sichtbar verändertes Haar aus den Randzonen werden mittels Pinzette epiliert und steril eingesendet.
- Bei Nägeln sollten von den zuletzt befallenen Arealen Abschabungen von der Nagelunterseite bevorzugt mit einer Nagelfeile, Nagelfräse oder Nagelschleifer gewonnen werden.
- Zum Nachweis von Skabies sollten ebenfalls Hautschuppen mit dem Skalpell gewonnen werden.
Punktate (Pleura-, Perikard-, Aszites-, Synovial- und andere Punktate)
- Hautoberfläche an der Punktionsstelle desinfizieren, die Einwirkzeit unbedingt einhalten und anschließend eine zweite Desinfektion durchführen.
- Möglichst 10 ml Flüssigkeit entnehmen und in sterilem Röhrchen versenden. Bei nur geringer Menge Punktatflüssigkeit sollte das Beimpfen einer Flüssigkultur, die sonst für die Blutkultur bei Kindern verwendet wird (BacT/ALERTR PF Plus, Best.-Nr. 207330), erwogen werden.
- Bei Verdacht auf Anaerobier sollte die aspirierte Probe nach Entfernen von Luftblasen in der Spritze belassen werden – die Kanüle dann durch einen sterilen Verschlussstopfen ersetzen und sofort ins Labor transportieren.
- Material bis zum Transport bei Raumtemperatur lagern, bei Außentemperaturen > 20 °C besser im Kühlschrank. Grundsätzlich verringert und verändert jede Art von Lagerung die Ausbeute.
Spezielle Informationen zu periprothetischen Infektionen siehe im A–Z-Teil
Sputum, Spülflüssigkeiten, Lavage
Sputum, Tracheal-, Bronchialsekret, Bronchialflüssigkeit
Zur Sputumgewinnung sollte der Mund gründlich mit Wasser ausgespült werden, um die physiologische Begleitflora zu reduzieren. Speichel aus dem Mundbereich ist zur Untersuchung ungeeignet. Für die Erregerisolierung besser geeignet sind bronchoskopisch gewonnene Trachealsekrete oder bronchoalveoläre Lavageflüssigkeit (BAL).
Probentransport taggleich bei Raumtemperatur, sonst Zwischenlagerung bei 4 °C; Pneumonie-Erreger (z.B. Haemophilus influenzae oder Pneumokokken) sind gegenüber Lagerung und Kühlung allerdings sehr empfindlich.
Zum Nachweis von Legionellen sind im Wesentlichen bronchoskopisch gewonnene Materialien (BAL) aus den tiefen Lungenabschnitten geeignet (bevorzugt PCR-Diagnostik).
Rachenspülflüssigkeit, Nasenspülflüssigkeit
Patienten mit ca. 10 ml physiologischer NaCl-Lösung 20 Sekunden gurgeln lassen und danach Spülflüssigkeit in einem sterilen Transportröhrchen auffangen.
Stand: 26.02.2021
-
Downloads