TDM: Wirksamkeit und Sicherheit antibiotischer Therapien verbessern
Therapeutisches Drug Monitoring (TDM) ermöglicht eine Orientierung über die individuellen Wirkstoffspiegel einzelner Medikamente bei Patient*innen. Dies stellt einen wertvollen Informationsgewinn für die Therapieführung dar.
TDM wird bereits seit vielen Jahren für eine eingeschränkte Auswahl an antibiotischen Substanzen wie Vancomycin und Gentamicin empfohlen und erfolgreich im klinischen Alltag umgesetzt. Dabei hilft ein TDM dieser Substanzen, auch primär unerwünschte Nebenwirkungen (UNW) wie Toxizität bei der Anwendung zu vermeiden.
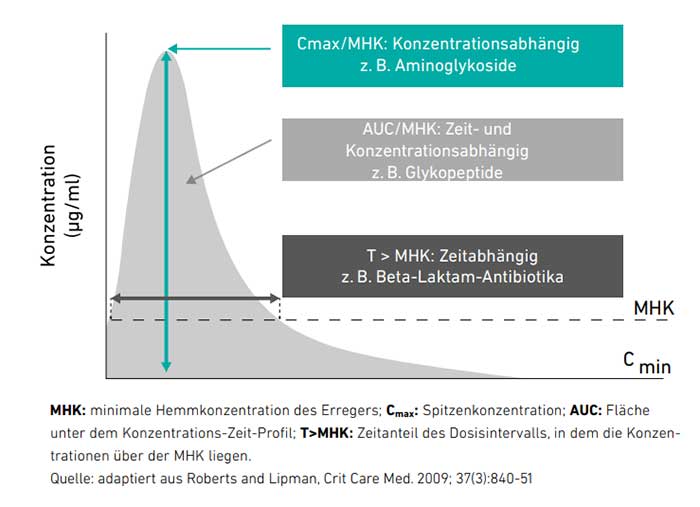
Abb. 1: Beschreibung verschiedener antimikrobieller Wirkstoffe unter Berücksichtigung von PK/PDIndizes: konzentrationsabhängig, zeitabhängig, und sowohl zeit- als auch konzentrationsabhängig

Da die Anwendung des TDMs bei der antiinfektiven Therapie nicht nur eine Reduzierung dosisabhängiger UNW ermöglicht, sondern auch therapeutische Erfolge/Heilungsraten und Therapiedauern positiv beeinflussen kann, stellt es insbesondere für kritisch kranke Patient*innen, Patient*innen mit Organinsuffizienz oder bei Infektionen mit multiresistenten Erregern einen wichtigen Grundpfeiler des Antimicrobial Stewardships dar.
Die Wirksamkeit von Antibiotika erklärt sich aus dem Zusammenspiel von Pharmakokinetik (PK; hierzu gehören: Resorption, Bioverfügbarkeit, Verteilungsvolumen, Metabolismus und Ausscheidung eines Arzneimittels) und Pharmakodynamik (PD; hierzu gehören: Wirkungen, Wirkmechanismen und unerwünschte Wirkungen eines Arzneimittels). Insbesondere bei Risikopatient*innen auf der Intensivstation kann für bestimmte Antiinfektiva ein TDM sinnvoll sein, um durch Ermittlung von sogenannten PK/PD-Indizes als Surrogatparameter die Wirksamkeit dieser Antiinfektiva besser abschätzen zu können. Gerade bei diesen Patient*innen kommt es u.a. durch Einschränkungen der Nieren-/Leberfunktion zu einer hohen Variabilität bei den möglichen zu erreichenden Antibiotikaspiegeln.
Auch die Kombination aus Wirkstoffspiegel, Applikationsform des Antibiotikums (Darreichung/Frequenz/Dauer), Zielgewebe und der minimalen Hemmkonzentration (MHK) des zu therapierenden Erregers spielen eine entscheidende Rolle.
Die folgenden PK/PD-Indizes werden bei antibiotischen Substanzen unterschieden und beim TDM berücksichtigt (siehe: Abb. 1):
- Konzentration des Wirkstoffspiegels oberhalb der minimalen Hemmkonzentration (z. B. bei Aminoglykosiden): Cmax/MHK
- Zeit des Wirkstoffspiegels oberhalb der minimalen Hemmkonzentration (z. B. Penicilline, Cephalosporine und Carbapeneme): T > MHK
- Fläche unterhalb der Kurve des Wirkstoffspiegels (AUC: area under the curve) sowie Fläche oberhalb der minimalen Hemmkonzentration (bei Fluorochinolonen, Glykopeptiden): AUC/MHK
Da wichtige pharmakokinetische Parameter, wie das Verteilungsvolumen und die Proteinbindung, maßgeblich vom Risikoprofil der Patient*innen, etwa dem Vorliegen einer Sepsis, Neutropenie, Dialysepflichtigkeit oder dem Körpergewicht, beeinflusst werden, wird ein TDM zur Optimierung der individuellen Antibiotikadosis bei entsprechenden Risikopatient*innen auf der Intensivstation empfohlen. Eine besondere Herausforderung ist hierbei die Antiinfektiva-Dosierung bei übergewichtigen Patient*innen. Grundsätzlich gilt, dass hydrophile Antiinfektiva (Beta-Laktame und Aminoglykoside), die sich weniger im Fettgewebe verteilen, nach dem Idealgewicht dosiert werden sollten, während lipophile Antinfektiva (Flourchinolone, Makrolide, Clindamycin, Tetracycline oder Voriconazol) eher nach dem tatsächlichen Gewicht dosiert werden sollten, da hier das Verteilungsvolumen größer ist.

Wirkstoffspiegel vieler Antibiotika (siehe Tab. 1) sind anfällig für Einflüsse in der präanalytischen Phase. Um verlässliche Werte in der Spiegelbestimmung zu erhalten, sollten die Proben unmittelbar nach Entnahme eingefroren und dann gefroren versandt werden (Ausnahmen siehe Tab. 1).
Gefrierbox zum Probentransport (Best.-Nr. 260485)
Die Dosierungsempfehlungen der unten aufgeführten Antibiotika werden vom Nationalen Antibiotika-Sensitivitätstest-Komitee stetig aktualisiert. Den jeweils gültigen Stand finden Sie hier: https://www.nak-deutschland.org/dosierungstabellen.html.
Beta-Laktam-Antibiotika
Beta-Laktam-Antibiotika haben ihre optimale Wirksamkeit bei Wirkstoffspiegeln, die möglichst lange oberhalb der MHK des zu therapierenden Bakteriums liegen (T/MHK). Dies kann mittels kontinuierlicher oder prolongierter Infusion erreicht werden. Hierbei ist die individuelle Stabilität der unterschiedlichen Substanzen in Lösung und die Temperatur zu berücksichtigen. Zur Bestimmung des Wirkstoffspiegels eignet sich der Zeitpunkt unmittelbar vor Applikation der nächsten Dosis bei intermittierender Applikation bzw. die Entnahme jederzeit bei kontinuierlicher Infusion.
Von einigen Expert*innen wird sogar als PK/PD-Ziel empfohlen, den Plasmaspiegel während des gesamten Dosierungsintervalls oberhalb des 2–4-fachen der MHK zu halten, um Spiegel-schwankungen entgegen zu wirken und den therapeutischen Erfolg durch Resistenzen nicht zu gefährden. Insbesondere die Spiegelbestimmung von Meropenem, Piperacillin, Ampicillin, Ceftazidim sowie Cefepim wird empfohlen und kann für den Therapieerfolg hilfreich sein.
Die separate Bestimmung der Spiegel von Betalaktamaseinhibitoren wie Sulbactam oder Tazobactam ist zum aktuellen Zeitpunkt nicht möglich und zielführend.
Aminoglykoside
Bei Gentamicin sowie anderen Substanzen aus der Gruppe der Aminoglykoside erfolgt ein TDM im Normalfall mittels Konzentrationsbestimmung nach Infusion (Cmax/MHK) für die Ermittlung des Spitzenspiegels und eine Konzentrationsbestimmung vor wiederholter Infusion (Cmin = Talspiegel) für die Abschätzung des potentiellen Risikos von UNW (Nephro- und Ototoxizität). Eine einmalig tägliche Applikation der Gesamtdosis von Gentamicin geht einher mit höherer Wirksamkeit und geringerer Toxizität im Vergleich zu fraktionierten Gaben (z. B. 3x täglich) und wird daher in der aktuellen Fachliteratur u.a. zur Therapie von Endokarditiden oder der Therapie von neutropenen Patienten empfohlen. Lediglich bei schwerwiegenden Endokarditiden (z. B. an Herzklappenprothesen) wird noch die Mehrfachgabe empfohlen.
Glykopeptide
In Deutschland ist die Durchführung von TDM bei Vancomycin seit langer Zeit bereits als Standard etabliert. Andere Glykopeptide finden in der Routineversorgung seltener Anwendung. Zumeist wird TDM mittels Bestimmung des Talspiegels bei zweimaliger Applikation pro Tag mit genutzt. In den vergangenen Jahren fand insbesondere die kontinuierliche Applikation auf Grund reduzierter Nephrotoxizität bei stationär versorgten Patient*innen häufiger Anwendung. Hierbei kann ein kontinuierlicher Wirkstoffspiegel ohne relevante Spitzenspiegel zur Therapiesteuerung genutzt werden.
In der aktualisierten US-amerikanischen Empfehlung zur Anwendung von Vancomycin wird ein TDM auf der Basis AUC/MHK als vorteilhaft benannt. Als Gründe hierfür werden im Vergleich zum Talspiegel basierten TDM deutlich reduzierte Raten an Nephrotoxizität und eine reduzierte Therapiedauer genannt. Darüber hinaus sind auch weniger Spiegelkontrollen erforderlich. Der PK/PD-Zielwert einer AUC/MHK sollte bei 400–600 mg/l*h liegen. Da bei Erregern mit MHK-werten von > 1mg/l eine AUC/MHK von > 400 mg/l*h nur schwer zu erreichen ist, empfehlen sich nach einer Loading-Dosis von 25–30 mg/kg KG dann Erhaltungsdosen von 15–20 mg/kg KG. Ab einem AUC/MHK-Wert von 600 mg/l*h treten vermehrt UNW wie Nephrotoxizität auf. Diese Zielwerte beziehen sich auf eine intermittierende Applikation und wurden bisher nicht für die kontinuierliche Applikation evaluiert.
Oxazolidinone
Bei Linezolid können erhebliche Schwankungen der Wirkstoffspiegel bei Patient*innen beobachtet werden, selbst wenn diese nicht kritisch erkrankt sind. Als Zielwert wird in der Literatur eine AUC/MHK von 80–120 benannt. Alternativ wird der Zeitraum des Wirkstoffspiegels von > 85% oberhalb der MHK genannt. Zur Steuerung der Erhaltungsdosis kann aus Gründen der Praktikabilität der Talspiegel (Cmin 2–7 mg/l oder 4–7 mg/l bei einer MHK von 4 mg/l) genutzt werden. Im Normalfall wird nicht das Dosisintervall von 12 h verändert, sondern die Erhaltungsdosis angepasst (300–2400 mg/Tag).
Zyklische Lipopeptide
Auch für Daptomycin konnte in vorangegangenen Untersuchungen eine große Variabilität bei Wirkstoffspiegeln beobachtet werden. Zudem wurde gezeigt, dass die zugelassene Höchstdosierung von 6 mg/kg KG/Tag bei einigen Krankheitsbildern mit einem reduzierten Therapieerfolg korreliert. Daher empfehlen einige Expert*innen Dosierungen von ≥ 8mg/kg KG/Tag, um Werte der AUC/MHK ≥ 700 zu erreichen. Bisher existieren keine konkreten Zielwerte für das AUC/MHK-basierte TDM von Daptomycin.
Tab. 1: Empfehlungen für PK/PD-Zielwerte sowie die Probennahme beim TDM
| Gruppe | Abnahme- zeitpunkte | Zielspiegel/PK/PD-Zielwert | Material | Temperatur Probe Versand |
|---|---|---|---|---|
| Beta-Laktam Ampicillin Piperacillin Ceftazidim Cefepim Meropenem | intermittierende Gabe: Cmin 1 Probe (bis 30 min vor der nächsten Dosierung) innerhalb der ersten 24–48 h nach Therapiebeginn | 100 % fT > MHK (optimal: 100 % fT > 2–4 × MHK) | Plasma | Gefroren |
| kontinuierliche Gabe: Css 1 Probe jederzeit während der Infusion | Css > MHK (optimal: Css > 2–4 × MHK) | |||
| Aminoglykoside Gentamicin | Cmax 1 Probe (bis 30 min nach Infusionsende) | Cmax/MHK ≥ 8–10 | Plasma/Serum | Raumtemperatur |
| Cmin 1 Probe (bis 30 min vor der nächsten Dosierung) | Cmin Gentamicin < 0,5 mg/l | |||
| Glykopeptide Vancomycin | intermittierende Gabe: AUC- basiertes Monitoring (empfohlen) 2 Proben (bis 30 min nach Infusionsende, 1–2 h vor nächster Dosierung) | AUC/MHK: 400–600 (empfohlen) | Plasma/Serum | Raumtemperatur |
| kontinuierliche Gabe: Css 1 Probe jederzeit während der Infusion | Css 20–25 mg/l | |||
| alternativ (bzgl. der Wirksamkeitunterlegen): Cmin 1 Probe (30 min vor der nächsten Dosierung) | Cmin 10–20 mg/l (15–20 mg/l bei schweren Infektionen, obsolet) | |||
| Oxazolidinone Linezolid | Cmin 1 Probe (bis 30 min vor der nächsten Dosierung, 48 h nach Therapiebeginn) | Cmin 2–7 mg/l 4–7 mg/l (bei MHK von 4 mg/l) | Plasma | Gefroren |
Cmin: Talspiegel, Cmax: Spitzenspiegel, Css: Spiegel unter Dauerinfusion, AUC: area under the curve, MHK: minimale Hemmkonzentration; f vor dem Index deutet an, dass sich der Index auf freie (d. h. nicht an Plasmaproteine gebundene) Arzneistoffkonzentrationen bezieht.
Quelle: adaptiert aus König C et al., Dtsch Med Wochenschr 2020; 145(24): 1764-1769. DOI: 10.1055/a-1207-1914
Literatur:
de With K et al.; AWMF-Nr.: 092/001 – Update 2018. S3-Leitlinie „Strategien zur Sicherung rationaler Antibiotika-Anwendung im Krankenhaus“.
Fratoni AJ et al.; Pharmacotherapy. 2021 Feb;41(2):220-233. doi: 10.1002/phar.2505.
Guilhaumou R et al.; Crit Care . 2019 Mar 29;23(1):104. doi: 10.1186/s13054-019-2378-9.
König C et al.; Dtsch Med Wochenschr 2020; 145(24): 1764-1769. DOI: 10.1055/a-1207-1914
Roberts and Lipman, Crit Care Med. 2009; 37(3):840-51
Rybak MJ et al. CID 2020;71(6):1361–4. doi: 10.1093/cid/ciaa303
-
Ansprechpartner
-
Downloads
