SARS-Coronavirus-2 PCR: Wie aussagekräftig ist der Ct-Wert?
Die Labore im LADR Laborverbund Dr. Kramer & Kollegen gehören zu den diagnostischen Leistungsträgern in Deutschland, auch in der Corona-Pandemie. Regelmäßig kommt in diesem Zusammenhang von Seiten einsendender Ärzte und medizinischer Einrichtungen die Frage nach der Bedeutung bzw. der Aussagekraft des Ct-Wertes bei der SARS-CoV-2-PCR auf. Darüber möchten wir Sie hier informieren.
Krankheitsverursachende Viren und Mikroorganismen können durch molekulare Verfahren wie die Polymerase-Kettenreaktion (PCR) nachgewiesen werden. Dabei werden eine oder mehrere spezifische Abschnitte des Genoms der Krankheitserreger (Zielsequenz der PCR) durch millionenfache Vermehrung (Amplifikation) sichtbar gemacht.
Nach initialer Aufspaltung der DNA in Einzelstränge binden die beiden Primer an jeweils ein Ende der Zielsequenz, die dann nachfolgend wieder zum Doppelstrang durch das hitzestabile Enzym DNA-Polymerase ergänzt wird. Bei der real time PCR binden spezifische Sonden an die so neugebildete DNA (Amplifikat). Diese Sonden sind mit einer fluoreszierenden Substanz markiert. Bei Zunahme der DNA steigt die Intensität der Fluoreszenz, bis sie messbar wird. Die exponentielle Amplifikation der Zielsequenz stellt sich dann als lineare Zunahme der Fluoreszenz dar. In dieser chemischen Reaktion ist die Konzentration der Zielsequenz in der Probe die einzige Variable, während die Konzentrationen der anderen Reaktanten definiert sind.
Damit gilt: je höher die Ausgangskonzentration der gesuchten Sequenz, desto geringer die Anzahl der erforderlichen Temperaturzyklen, bis die Fluoreszenz ansteigt. Der Beginn der Linearität der Fluoreszenz wird als Ct-Wert (Ct = Crossing threshold oder Cp-Wert = Crossing point) bezeichnet. Er wird angegeben mit der Anzahl der Temperaturzyklen zu diesem Zeitpunkt. Damit wird deutlich, dass der Ct-Wert mit der Viruskonzentration im Untersuchungsmaterial korreliert, es gibt jedoch viele Einflüsse.
Was beeinflusst den gemessenen Ct-Wert?
Analytik:
- RNA-Extraktion: Die in der Probe vorhandene virale RNA muss extrahiert und mögliche Hemmstoffe der PCR müssen eliminiert werden, was methodenabhängig unterschiedlich gut gelingt.
- Die PCR amplifiziert nur DNA. Das heißt, die extrahierte RNA muss im ersten Schritt der PCR mit dem Enzym Reverse Transkriptase (RT-PCR) in doppelsträngige DNA umgeschrieben bzw. kopiert werden – daher der Begriff „copy DNA“ (cDNA). Wie bei jeder chemischen Reaktion hängt die Effizienz vom Mischungsverhältnis der Reaktanten ab und kann daher variieren.
- Der Ct-Wert hängt vor allem von der Konzentration der spezifischen Zielsequenz in der Probe ab. Je höher die Konzentration, desto weniger Temperaturzyklen sind erforderlich, um eine exponentielle Amplifikation zu erreichen (niedrige Ct-Werte).
- Bei voll automatisierten PCR-Systemen bestimmt ein hinterlegter Algorithmus den Ct-Wert jeder gemessenen Probe und teilt nur das Ergebnis mit. Bei allen anderen Systemen legen die Untersuchenden anhand mitgeführter Kontrollen sowie anhand ihrer eigenen Erfahrung die Schwelle der Hintergrundfluoreszenz und damit den Beginn der linearen Fluoreszenz für jede Probe fest.
Präanalytik:
- Nur bei korrekt durchgeführtem Abstrich kann davon ausgegangen werden, dass ausreichend Sekret mit Viren aus dem Rachenraum für die Diagnostik gewonnen wurde.
- Feste Transportmedien können PCR Hemmstoffe beinhalten und damit die Amplifikation erschweren oder gar komplett verhindern. Zudem reduzieren sie das für die Extraktion verfügbare Untersuchungsmaterial.
- Bei Probennahme ist zu klären, ob ein Abstrich des Rachenraums überhaupt zur Diagnostik geeignet ist. Bei einer Pneumonie findet die Virusvermehrung vor allem in den unteren Atemwegen statt. Ist das der Fall, könnte ein Abstrich der Rachenhinterwand möglicherweise keine virale RNA aufnehmen und die SARS-CoV-2 RT-PCR trotz Covid-19 Pneumonie negativ bleiben!
Interpretation der Ergebnisse der SARS-CoV-2 real time RT-PCR
Kann man den Gehalt viraler RNA in einer Probe mittels real time PCR überhaupt quantifizieren?
Ja – aber nur, wenn …
- das Untersuchungsmaterial eine gleichbleibende Qualität aufweist (z. B. Blut),
- eine Standardkurve anhand definierter RNAKonzentrationen bestimmt wurde und
- entweder diese oder zumindest einige Proben dieser Kurve in jeder Testung mitgeführt und bestimmt werden.
Die virale RNA-Konzentration der Probe wird dann durch Vergleich mit der Standardkurve ermittelt. Beispiele hierfür sind die quantitative HIV- und die HCV-PCR aus dem Blut. Trotz Standardisierung beträgt die tolerierte Variabilität dieser Methoden eine Log-Stufe (= 3,3 Zyklen oder 3,3 Ct-Werte). Das heißt, die „wahre“ Konzentration bei Angabe von 100.000 HIV-RNA Kopien/ml Blut liegt zwischen etwa 32.000 und 316.000 Kopien/ml. [Mit herzlichem Dank an einen aufmerksamen Leser für die korrekte Umrechnung der Logarithmen]
Bei einem so inhomogenen Untersuchungsmaterial wie einem Rachenhinterwandabstrich ist eine Quantifizierung zum Vergleich der Viruslast aus unterschiedlichen Abstrichen kaum möglich.
Kann man anhand der Ergebnisse einer real time PCR die Konzentration der SARS-COV-2- RNA bestimmen?
Nein. Es handelt sich um eine qualitative und nicht um eine quantitative PCR: Ohne eine Standardkurve kann nur mitgeteilt werden, ob SARS-CoV-2-RNA nachgewiesen wurde oder nicht.
Warum wird beim Ergebnis zwischen nachgewiesen und schwach nachgewiesen unterschieden?
Alle Labore mussten Erfahrungen in der Diagnostik dieser neuen Viruskrankheit sammeln. Bei Beobachtung von Kontaktpersonen zeigt sich im Verlauf, dass nach etwa fünf Tagen kurz vor Auftreten von Symptomen Virus-RNA in geringer Konzentration (= hohe Ct-Werte) nachweisbar wird, dann in höherer Konzentration (= niedrige Ct-Werte), um dann wieder abzufallen (hohe CtWerte bzw. nicht nachgewiesen).
Initial bestand auch von Seiten der Labore Unsicherheit, welche Bedeutung der Nachweis geringer Konzentrationen der viralen RNA hat. Aber auch diese semiquantitative Aussage setzt voraus, dass der Abstrich korrekt durchgeführt wurde und keine Pneumonie vorliegt. Die Lunge ist dann der wesentliche Ort der Virusvermehrung. Entsprechend ist BAL-Flüssigkeit oder Bronchialsekret direkt aus der Lunge das besser geeignete Untersuchungsmaterial!
Schema der Viruskonzentration, Kontagiösität und analytischen Sensitivität von Testverfahren im Verlauf der SARS-CoV-2- Infektion Modifiziert nach Mina MJ et al. (1)
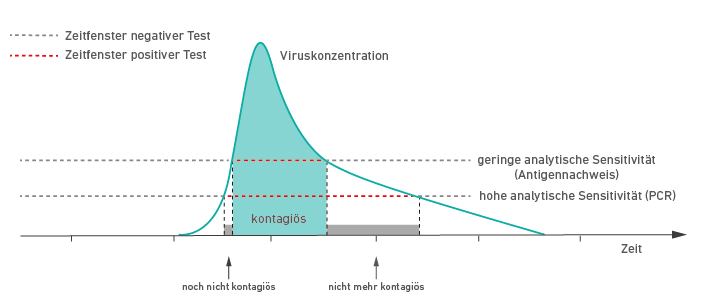
Bedeutet ein hoher Ct-Wert, dass die untersuchte Person nicht ansteckend ist?
Nein. Wie anhand des schematischen Verlaufes in Abb. 1 zu erkennen, wird ein hoher Ct-Wert (geringe Viruskonzentration) sowohl zu Beginn der Infektion als auch in der Abheilung beobachtet. Zu Beginn ist der Wert trügerisch, da der Untersuchte binnen Stunden bzw. innerhalb von ein bis zwei Tagen hochgradig ansteckend wird. Die Wahrscheinlichkeit, das Virus anzuzüchten, korreliert mit der Viruskonzentration. Und damit korreliert sie invers mit den Ct-Werten. Je niedriger der Ct-Wert und je höher die Viruskonzentration, desto wahrscheinlicher ist die Virusanzucht, sprich die Infektiösität der Probe (2).
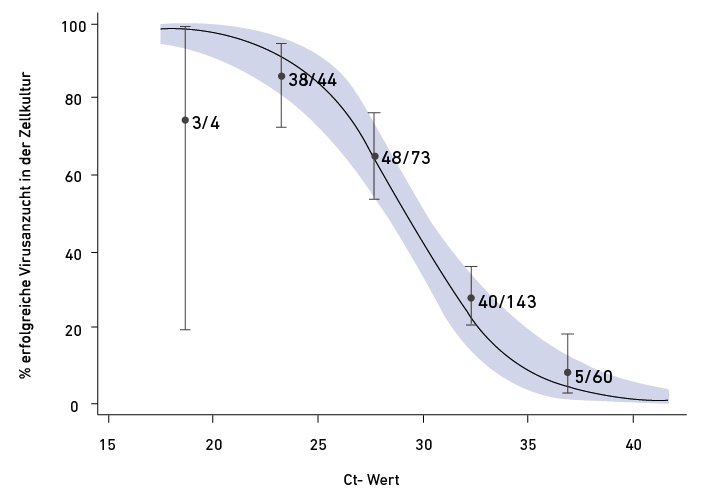
Bedeutet ein niedriger Ct-Wert immer, dass die untersuchte Person hochgradig ansteckend ist?
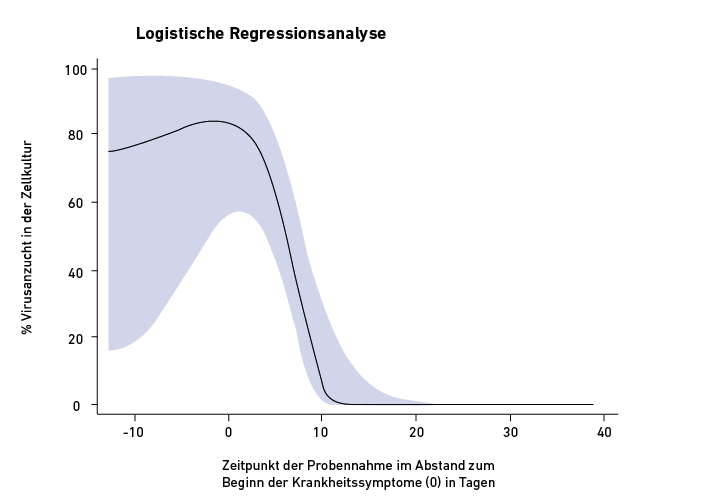
Nein! Der Nachweis von Virus-RNA sagt nichts über die Vermehrungsfähigkeit der Viren aus. Diese können bereits durch das Immunsystem inaktiviert worden sein, aber die RNA bleibt noch nachweisbar. Das zeigt sich in einer Verlaufsbeobachtung von Patienten mit einem milden bis moderaten Verlauf der Virusinfektion, dargestellt in Abb. 2. Das wesentliche Ergebnis dieser Studie ist, dass das Virus etwa zehn Tage nach Beginn der Symptomatik unabhängig vom Ct-Wert nicht mehr angezüchtet werden kann. Das bedeutet, dass der Patient zu diesem Zeitpunkt nicht mehr ansteckend ist. Das entspricht den Erfahrungen bei anderen viralen Atemwegserkrankungen, wie der Grippe durch Influenzaviren.
Sind die Ct-Werte der verschiedenen PCRVerfahren zum Nachweis von SARS-CoV-2 identisch?
Nein. Sensitivität und Nachweisgrenze der verschiedenen PCR-Verfahren sind unterschiedlich. Zwecks Vergleichbarkeit der Ct-Werte wurde vom Nationalen Konsiliarlaboratorium für Coronaviren, dem Robert Koch-Institut, und INSTAND e.V. ein Ringversuch mit zwei Proben mit definierten SARS-CoV-2 Konzentrationen von 1 Million und 10 Millionen RNA-Kopien/ml an Labore versendet. Erbeten wurde die Rückmeldung der gemessenen Ct-Werte der verwendeten PCR-Verfahren, um diese Konzentrationen nachzuweisen. Die im LADR Zentrallabor in Geesthacht verwendeten PCRs benötigten minimal 22 und maximal 27 PCRZyklen, um die hohe bzw. niedrige Konzentration nachzuweisen.
Laut Konsiliarlabor und RKI begrenzen diese beiden Ct-Werte den Schwellenbereich der jeweiligen Methode. Ct-Werte unterhalb des Schwellenbereiches, also Virus-RNA in dieser oder sogar höherer Konzentration, sind mit Kontagiosität des Untersuchten vereinbar. Der höhere Ct-Schwellenwert wird in den vom RKI vorgeschlagenen Befundkommentaren und im Entlassmanagement vom 30.11.2020 berücksichtigt (3). Vorsorglich wurde eine Log-Stufe als Sicherheitspuffer zugefügt, so dass für alle im Zentrallabor verwendeten PCR-Verfahren der Schwellenwert einheitlich bei Ct 30 liegt. Jedes Labor muss die Zykluszahl des Schwellenbereiches selbst bestimmen. Daher kann die Ct-Angabe abhängig vom Test und Labor variieren, aber der Schwellenwert hat immer dieselbe Bedeutung.
Virusanzucht in der Zellkultur im Krankheitsverlauf in Abhängigkeit vom Abstand zum Beginn der Krankheitssymptome (0) bei Infektion mit SARS-CoV-2 (n = 246)
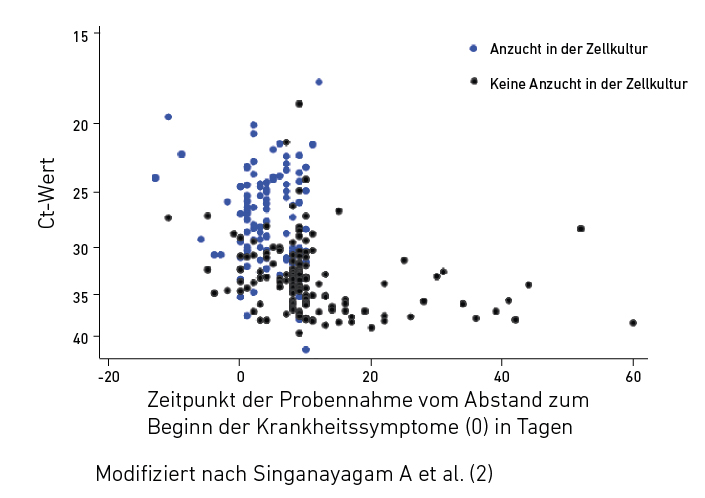
Die Befundkommentare lauten daher zukünftig:
SARS-Coronavirus-2-RNA: nachgewiesen
Der Nachweis viraler RNA mittels RT-PCR mit Zielsequenzen im E-, N-, RdRP-, S- und/oder ORF-Gen [Angabe entsprechend der jeweils verwendeten PCR-Methode] ist mit einer SARSCoV-2 Infektion vereinbar. Die nachgewiesene hohe Viruskonzentration liegt oberhalb des ermittelten Schwellenbereiches für die Infektiösität des Materials in der Zellkultur (Ct-Wert < 30). Daher ist von einer Kontagiosität des Patienten auszugehen. Aber die Beurteilung der Kontagiosität wie auch die klinische Gesamteinschätzung müssen den Zeitpunkt der Probennahme nach Kontakt oder nach Symptombeginn, die Art und Qualität der Probennahme sowie alle klinischen Begleitumstände berücksichtigen!
SARS-Coronavirus-2-RNA: in geringer Konzentration nachgewiesen
Der Nachweis viraler RNA mittels RT-PCR mit Zielsequenzen im E-, N-, RdRP-, S- und/oder ORF-Gen [Angabe entsprechend der jeweils verwendeten PCR-Methode] ist mit einer SARSCoV-2 Infektion vereinbar. Die nachgewiesene geringe Viruskonzentration liegt unterhalb des ermittelten Schwellenbereiches für die Infektiösität des Materials in der Zellkultur (Ct-Wert > 30). Der Befund erfüllt damit die PCRKriterien des RKI-Entlassmanagements. Das Ergebnis allein erlaubt jedoch keine Beurteilung der Kontagiosität des Patienten, da hierfür die Symptomatik, Art und Zeitpunkt der Probennahme seit Symptombeginn oder seit Exposition berücksichtigt werden müssen! Vorsorglich wird darauf hingewiesen, dass fehlerhafte Probennahmen, wie auch eine vornehmlich intrapulmonale Virusvermehrung bei Pneumonie trotz hoher Kontagiosität des Patienten zu einer geringen Viruskonzentration im Nasen- und Rachenabstrich führen kann!
SARS-Coronavirus-2-RNA: nicht nachgewiesen
Kein Nachweis viraler RNA mittels RT-PCR mit Zielsequenzen im E-, N-, RdRP-, S- und/oder ORF-Gen [Angabe entsprechend der jeweils verwendeten PCR-Methode]. Das Laborergebnis allein erlaubt aber keinen kompletten Ausschluss einer SARS-CoV-2 Infektion, da hierfür Angaben zur Anamnese, Klinik und Präanalytik (z. B. Zeitpunkt, Art und Qualität der Probenahme nach Exposition bzw. Symptombeginn) berücksichtigt werden müssen! SARS-CoV-2-RNA ist meist frühestens fünf Tage nach Exposition nachweisbar. Entscheidend für die Sensitivität der PCRVerfahren ist die Qualität der Probennahme. Auch eine vornehmlich intrapulmonale Virusvermehrung wie bei einer Pneumonie kann mit einem negativen PCR-Ergebnis von Nasen- und Rachenabstrichen einhergehen!
Literatur
- Mina MJ et al. Perspective: Rethinking Covid-19 test sensitivity – a strategy for containment. N Engl J Med 2020; 383: e 120 November 26, 2020
- Singanayagam A et al. Duration of infectiousness and correlation with RT-PCR cycle threshold values in cases of COVID-19, England, January to May 2020. Eurosurveillance J 2020; 25, Issue 32, August 2020
- Robert Koch-Institut. COVID-19: Entlassungskriterien aus der Isolierung Orientierungshilfe für Ärztinnen und Ärzte. Stand 30.11.2020
-
Analysen
-
Ansprechpartner
-
Downloads
