Kenkre JS, Bassett J. The bone remodelling cycle. Ann Clin Biochem. 2018 55(3):308-327. doi: 10.1177/0004563218759371.
Hlaing TT, Compston JE. Biochemical markers of bone turnover - uses and limitations. Ann Clin Biochem. 2014 51(Pt 2):189-202. doi: 10.1177/0004563213515190.
Bhattarai HK et al. Vitamin D, Calcium, Parathyroid Hormone, and Sex Steroids in Bone Health and Effects of Aging. J Osteoporos. 2020 2020:9324505. doi: 10.1155/2020/9324505.
Wittkowske C, Reilly GC, Lacroix D, Perrault CM. In Vitro Bone Cell Models: Impact of Fluid Shear Stress on Bone Formation. Front Bioeng Biotechnol. 2016 4:87. doi: 10.3389/fbioe.2016.00087.
Knochenstoffwechsel - Das Gleichgewicht zwischen Aufbau und Abbau
Knochen sind nicht nur ein wesentlicher Teil unseres Stütz- und Bewegungsapparates, sondern beherbergen auch das blutbildende Stammzellgewebe und spielen eine Rolle im Mineral- sowie Säure-Base-Haushalt (1). Um den mechanischen Belastungen gleichbleibend standhalten zu können, unterliegen sie auch nach Abschluss des Körperwachstums einem ständigen Auf- und Abbau (Remodelling).
So werden innerhalb eines Jahres bis zu 10 % der Knochenmasse ersetzt. Dabei fungieren Osteozyten, also reife Knochenzellen, als Mechanosensoren, die physikalische Reize erfassen und die Aktivität von Osteoklasten (abbauende Zellen) und Osteoblasten (aufbauende Zellen) regulieren. Abhängig von Alter, Ernährung und Hormonstatus können Störungen im Knochenstoffwechsel auftreten, die mit einer Verringerung der Knochendichte (Osteoporose) und damit einer erhöhten Anfälligkeit für Frakturen einhergehen. Da eine Osteoporose zunächst symptomlos verläuft, kann neben den bildgebenden Verfahren auch eine laborchemische Analyse unterschiedlicher Parameter sinnvoll sein.
Zusammenspiel von Osteoblasten und Osteoklasten
Die Knochenmatrix unterliegt einem ständigen Umbau. Dabei bauen die Osteoblasten die Knochensubstanz auf, bilden das Kollagen und schaffen eine Umgebung zur Bildung des Hydroxylapatits. Osteoklasten sind mehrkernige Riesenzellen und bauen kontinuiertlich Knochensubstanz ab. Im physiologischen Gleichgewicht macht ein Osteoklast die Arbeit von etwa 100 Osteoblasten zunichte. Sowohl Osteoblasten als auch Osteoklasten werden hormonell reguliert.
Knochenstoffwechsel
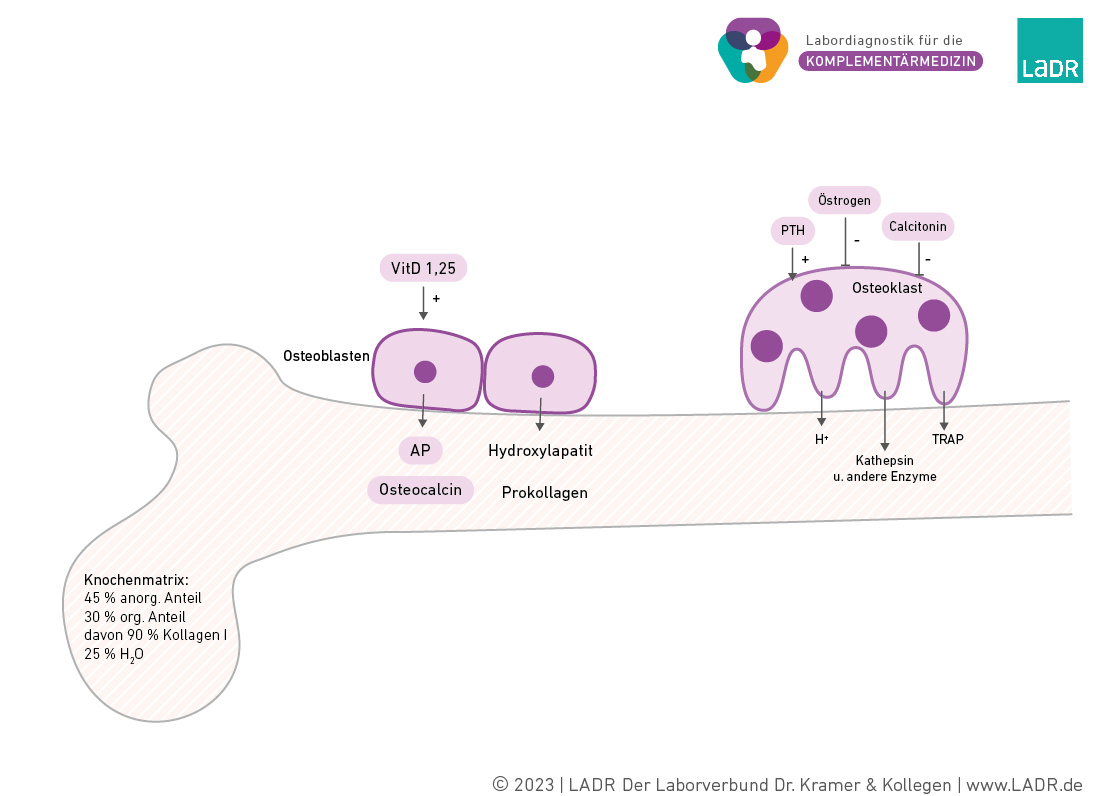

Die Knochenmatrix besteht zu 45% aus Hydroxylapatit (anorgan. Anteil), zu 30% aus Kollagen, wobei der Typ I überwiegt, und zu ca. 25% aus Wasser. Kollagen ist ein modifiziertes Protein, das von den Osteoblasten synthetisiert wird. Das 1,25-Dihydroxy-Vitamin-D-Hormon wirkt auf die Osteoblasten, die Ostase (Knochenspezifische Alkalische Phosphatase) und Osteocalcin abgeben. Dies fördert die Mineralisierung des Knochens, d.h. Calcium und andere Ionen organisieren sich zum knochentypischen ‚Mineral‘ Hydroxylapatit. Osteoklasten bilden mit ihren Zellausläufern Lakunen, in die sie Protonen (H+, Säure) und kollagenspaltende Enzyme abgeben. Durch die Lakunenbildung wird der Knochenabbau räumlich begrenzt. Beeinflusst durch hormonelle Veränderungen überwiegt in Wachtumsphasen der Knochenaufbau und im Alter der Knochenabbau (Osteoporose).
Das Knochengewebe, in das alle Knochenzellen eingebettet sind, enthält zu 60-70% anorganische Mineralien, zu 20-25% organische Substanzen und zu 10-15% Wasser. Die anorganischen Ionen, vor allem Calcium und Phosphat, bilden das Hydroxylapatit. 99% des Calciums und 85% des Phosphors im Körper sind in Knochen und Zähnen eingelagert. Die Aufnahme von Calcium im Darm und der Einbau in den Knochen wird von Vitamin D reguliert. Vitamin D3 (Cholecalciferol) kann entweder durch die Nahrung aufgenommen oder in der Haut nach Sonnenlichtexposition aus dem endogenen Provitamin (7-Dehydrocholesterol) gebildet werden. In der Leber erfolgt anschließend eine Aktivierung zu Calcidiol (25-Hydroxy-Vitamin D3), das gebunden an Vitamin D-Bindeproteine (DBP) durch den Körper zirkuliert. Vor allem in der Niere findet dann die weitere Hydroxylierung zum physiologisch aktiven 1,25-Dihydroxy-Vitamin D3 (Calcitriol) statt. Dies bindet an den Vitamin D-Rezeptor (VDR) in den Darmzellen und initiiert die aktive Aufnahme von Calcium aus der Nahrung und steigert zusätzlich die von Phosphat. Der erhöhte Calciumspiegel im Blut, aber auch das Calcitriol selbst stimulieren dann den Knochenaufbau.
Calcitriol wirkt dabei direkt auf Osteoblasten und induziert die Bildung von Osteocalcin, einem kleinen Protein, das in die extrazelluläre Knochenmatrix abgegeben wird (2). Unter Beteiligung von Vitamin K erfolgt dort eine Carboxylierung, so dass Osteocalcin an Calcium binden und die Mineralisierung bewirken kann. Aufgrund dieses Zusammenwirkens werden Vitamin D und Vitamin K häufig gemeinsam supplementiert.
Ein weiterer Marker für den Knochenaufbau ist die knochenspezifische Alkalische Phosphatase (AP), auch Ostase genannt (2). Hierbei handelt es sich um eine von den Osteoblasten sezernierte Isoform des Enzyms, die einen Hinweis auf die Aktivität der Zellen liefert und deren Menge im Blut mit der Knochenbildungsrate korreliert. Kinder und Jugendliche haben einen hohen Plasmaspiegel, da das Knochenwachstum bei ihnen noch nicht abgeschlossen ist, ebenso Schwangere aufgrund der Knochenbildung beim Föten. Erhöhte Werte bei Erwachsenen können auf Knochenbrüche, aber auch Osteoporose deuten.
Da Calcium auch eine entscheidende Rolle bei vielen Stoffwechselvorgängen innerhalb der Zelle, der Erregung von Nerven- und Muskelzellen sowie der Blutgerinnung spielt, muss der Körper die Konzentration des freien Ions im Blut relativ konstant halten (Calcium-Homöostase). Dies geschieht einerseits im Darm über die Aufnahme aus der Nahrung, aber auch durch die regulierte Ausscheidung über den Harn oder durch die Freisetzung aus bzw. den Einbau in Knochenmaterial.
Niedrige Mengen an Calcium und Calcitriol (1,25-Dihydroxy-Vitamin D3) im Blut führen zur Ausschüttung von Parathormon (PTH) aus der Nebenschilddrüse (3). Dieses aktiviert das für die Bildung von Calcitriol verantwortliche Enzym in der Niere und verstärkt damit die Calciumaufnahme im Darm. Des Weiteren fördert PTH die Rückresorption in der Niere und löst eine Mobilisierung von Calcium aus dem Knochen aus.
Kollagensynthese und Kollagenabbau
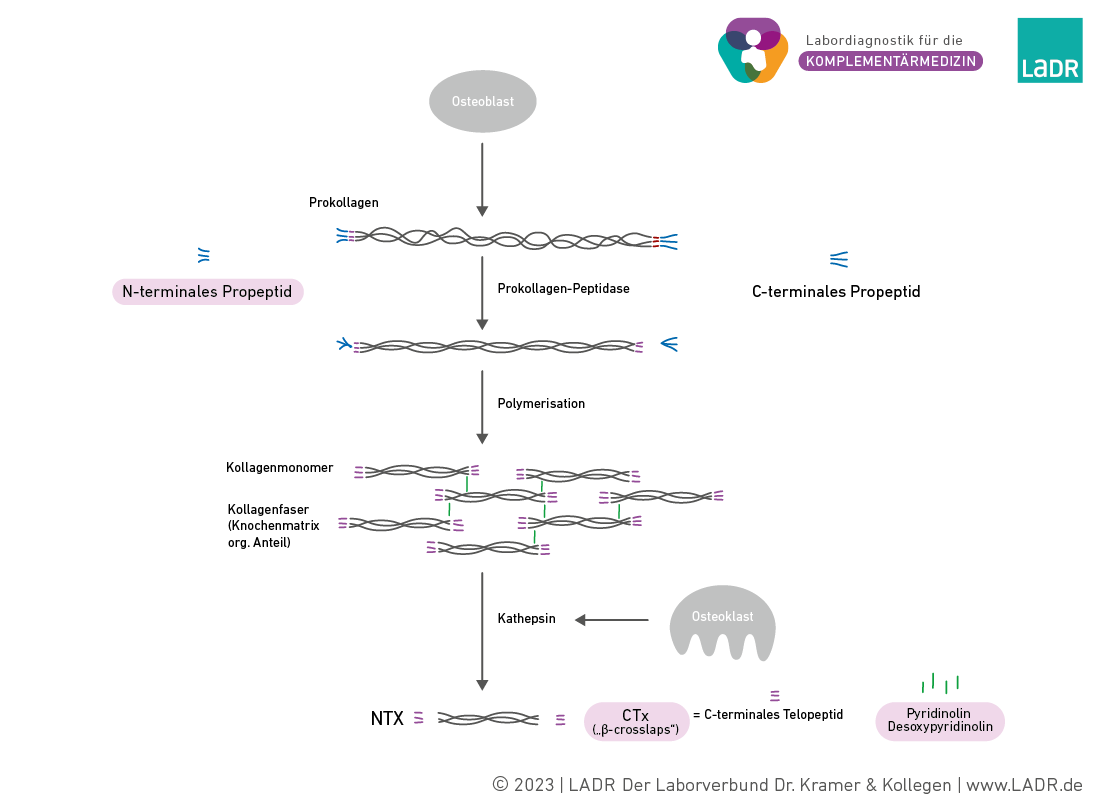

Der organische Anteil der Knochenmatrix besteht fast vollständig aus Fasern des Proteins Kollagen Typ I. Diese bilden eine Gerüststruktur, das Osteoid, das dem Knochen Elastizität, Flexibilität und Dehnfestigkeit verleiht. Durch die Einlagerung von Hydroxylapatit erhält der Knochen dann seine Druckfestigkeit. Aktive Osteoblasten sezernieren Prokollagen, ein Vorläufermolekül aus drei umeinander gewickelten Peptidketten, die an beiden Enden noch Verlängerungen besitzen (4). Sobald sich die Prokollagen-Moleküle in der extrazellulären Matrix befinden, werden die Verlängerungen von spezifischen Peptidasen abgespalten, so dass Tropokollagen und P1NP-(Prokollagen-Typ I N-terminales Propeptid) sowie P1CP-(Prokollagen-Typ I C-terminales Propeptid) Fragmente entstehen (3). Die Tropokollagen-Moleküle bilden dann spontan Kollagenfibrillen, in denen zur Stabilisierung die Enden der Moleküle über Querverbindungen (Crosslinks) aus Pyridinolin (PYD) und Deoxypyridinolin (DPD) kovalent verknüpft sind. Viele Fibrillen bilden dann Fasern aus.
Beim Abbau reifer Kollagenfasern aufgrund erhöhter Osteoklastenaktivität werden vermehrt PYD und DPD freigesetzt und über den Urin ausgeschieden, wo sie labordiagnostisch nachgewiesen werden können. Alternativ können Crosslinks, die noch mit den endständigen Telopeptiden der Tropokollagene verbunden sind, sogenannte b-Crosslaps (b -CTx), immunologisch im Serum detektiert werden. Beide Parameter dienen als Marker für einen verstärkten Knochenabbau. Der Nachweis von b-Crosslaps zeigt Veränderungen im Knochenstoffwechsel bereits nach 3 Monaten an, deutlich schneller als beispielsweise eine Knochendichtemessung.
| Parameter | Material |
|---|---|
| Vitamin D, 1,25-Di-OH- (1,25-Dihydroxycholecalciferol) | Serum |
| Ostase (Knochen-AP) | Serum |
| β-Crosslaps (CTx) | Serum |
| P1NP (Prokollagen Typ 1 N-terminales Propeptid) | Serum |
| Desoxy-Pyridinolin (DPD)-Crosslinks | Morgenurin |
| Parathormon, intakt | EDTA-Plasma |
| Vitamin K1 (α-Phyllochinon) | Serum |
-
Analysen
-
Downloads
-
Seminare
-
Konsiliarnetzwerk









































