Serek P, Oleksy-Wawrzyniak M. The Effect of Bacterial Infections, Probiotics and Zonulin on Intestinal Barrier Integrity. Int J Mol Sci. 2021; 22, 11359. doi: 10.3390/ijms222111359.
Usuda H, Okamoto T, Wada K. Leaky Gut: Effect of Dietary Fiber and Fats on Microbiome and Intestinal Barrier. Int J Mol Sci. 2021; 22, 7613. doi: 10.3390/ijms22147613.
Schoultz I, Keita ÅV. The Intestinal Barrier and Current Techniques for the Assessment of Gut Permeability. Cells. 2020; 9, 1909. doi: 10.3390/cells9081909.
Johansson ME, Hansson GC. Immunological aspects of intestinal mucus and mucins. Nat Rev Immunol. 2016; 16:639-49. doi: 10.1038/nri.2016.88.
Ohno H. Intestinal M cells. J Biochem. 2016; 159:151-60. doi: 10.1093/jb/mvv121.
Murphy K, Weaver C. Das mucosale Immunsystem. Janeway Immunologie. 2018; 641–91. German. doi: 10.1007/978-3-662-56004-4_12.
Di Tommaso N, Gasbarrini A, Ponziani FR. Intestinal Barrier in Human Health and Disease. Int J Environ Res Public Health. 2021; 18, 12836. doi: 10.3390/ijerph182312836.
Vancamelbeke M, Vermeire S. The intestinal barrier: a fundamental role in health and disease. Expert Rev Gastroenterol Hepatol. 2017; 11:821-834. doi: 10.1080/17474124.2017.1343143.
Inczefi O, et al. The Influence of Nutrition on Intestinal Permeability and the Microbiome in Health and Disease. Front Nutr. 2022; 9, 718710. doi: 10.3389/fnut.2022.718710.
Rohr MW, et al. Negative Effects of a High-Fat Diet on Intestinal Permeability: A Review. Adv Nutr. 2020;11:77-91. doi: 10.1093/advances/nmz061.
Sturgeon C, Fasano A. Zonulin, a regulator of epithelial and endothelial barrier functions, and its involvement in chronic inflammatory diseases. Tissue Barriers. 2016; 4, e1251384. doi: 10.1080/21688370.2016.1251384.
Al-Ayadhi L, et al. The use of biomarkers associated with leaky gut as a diagnostic tool for early intervention in autism spectrum disorder: a systematic review. Gut Pathog. 2021; 13, 54. doi: 10.1186/s13099-021-00448-y.
Cobo ER, Chadee K. Antimicrobial Human β-Defensins in the Colon and Their Role in Infectious and Non-Infectious Diseases. Pathogens. 2013; 2:177-92. doi: 10.3390/pathogens2010177.
Leaky gut
Die Darmschleimhaut bildet durch ihre unzähligen Falten und Zotten die größte Kontaktfläche des Körpers zur Außenwelt. Sie wirkt als selektiv permeable Barriere, die einerseits die Aufnahme von Nährstoffen erlaubt, andererseits aber das Eindringen von Pathogenen und Toxinen verhindert.
Aufbau der Darmbarriere
Entscheidend für die Undurchlässigkeit der Darmbarriere ist ein enger Zellkontakt, sodass ein unkontrolliertes, parazelluläres Eindringen von Substanzen aus dem Darmlumen ins Körperinnere unterbunden wird. Eine wichtige Komponente dieser Barriere sind die Tight-Junctions (TJ), die sich auf der luminalen Seite bandförmig um alle Darmepithelzellen ziehen und die sog. Zonula occludens bilden (auch Schlussleistennetz).
Zell-Zell-Kontakte des Darmepithels
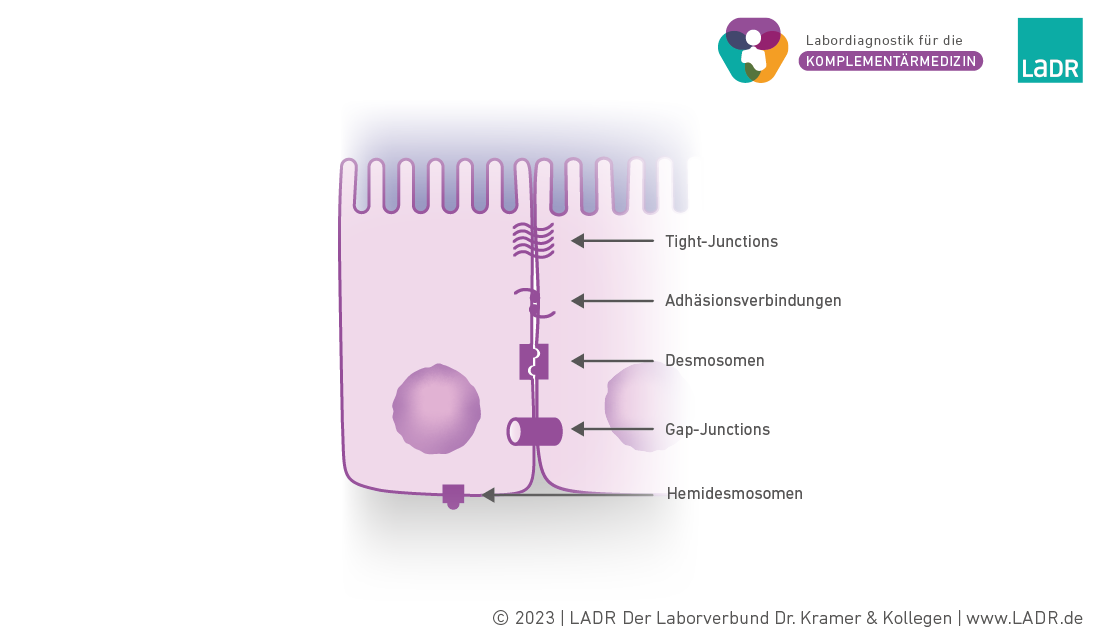

Tight-Junctions bestehen aus u.a. Occludin und Claudin und bilden die Zonula occludens. Adhäsionsverbindungen bestehen aus u.a. Cadherin und Catenin und bilden die Zonula adherens. Über die Zonulae (lat.: Gürtel) ist jede Zelle mit allen Nachbarzellen verbunden. Desmosomen sind punktförmige Zell-Zell-Verbindungen, die aus Desmoplakin bestehen. Hemidesmosomen verbinden die Zelle mit Komponenten der Basallamina (Zell-Matrix-Verbindung). Die verschiedenen Zell-Zell- und Zell-Matrix-Kontakte stehen intrazellulär mit verschiedenen Proteinen des Zytoskeletts in Verbindung. Gap-Junctions sind verschließbare Kanäle, die einen Stoffaustausch von Zell zu Zelle ermöglichen.
Die gesunde Darmmukosa
Eine gesunde Darmmukosa steuert den Stofftransport zwischen Darmlumen und Körperinnerem auf zwei Arten (1, 2, 3). Der passive parazelluläre Transport durch den Zwischenraum benachbarter Zellen hängt von Größe und Eigenschaften der Poren in den Tight Junctions ab. Auf diesem Weg können vor allem Wasser, Ionen und kleine Moleküle unter 600 Da Größe passieren. Die Durchlässigkeit variiert regional und ist im Dünndarm deutlich höher als im Dickdarm. Der transzelluläre Transportweg hingegen führt direkt durch die Enterozyten. Kleine lipophile Substanzen werden passiv über die Zellmembran resorbiert. Die meisten Nährstoffe wie Zucker, Aminosäuren, Vitamine etc. gelangen allerdings gekoppelt an eine Na+/K+-Pumpe, also aktiv, über spezifische Transportsysteme in die Zellen und werden dann passiv an der basalen Seite der Epithelzelle abgegeben.
M-Zellen sind für den Transport von Antigenen aus dem Darmlumen zu den in der Lamina propria befindlichen Immunzellen des darmassoziierten Lymphgewebes (gut-associated lymphoid tissue, GALT) verantwortlich (4, 5, 6). Das mucosale Immunsystem des Darms ist das größte Immunorgan des Körpers und beherbergt etwa drei Viertel der Lymphozyten. Sie nehmen Mikroorganismen und Partikel durch Endozytose auf und leiten sie an die darunterliegenden Peyer-Plaques (Dünndarm) und isolierten Lymphfollikel weiter. Dort prozessieren und präsentieren Dendritische Zellen die Antigene und aktivieren so lokale T- und B-Lymphozyten.
Plasmazellen der Schleimhaut sezernieren vorwiegend Antikörper des IgA-Subtyps, die als Dimer, verknüpft durch eine J-Kette, vorliegen. Der Transport der IgA-Moleküle aus dem Subepithelialraum ins Darmlumen erfolgt mittels rezeptorvermittelter Transzytose durch die M-Zellen. Da bei der Freisetzung ins Darmlumen die sekretorische Komponente an den Antikörpern verbleibt, werden sie auch als sekretorische IgAs (sIgAs) bezeichnet. Die sekretorische Komponente verhindert den vorzeitigen Abbau der sIgAs durch Verdauungsenzyme (6).
Physiologische Darmbarriere
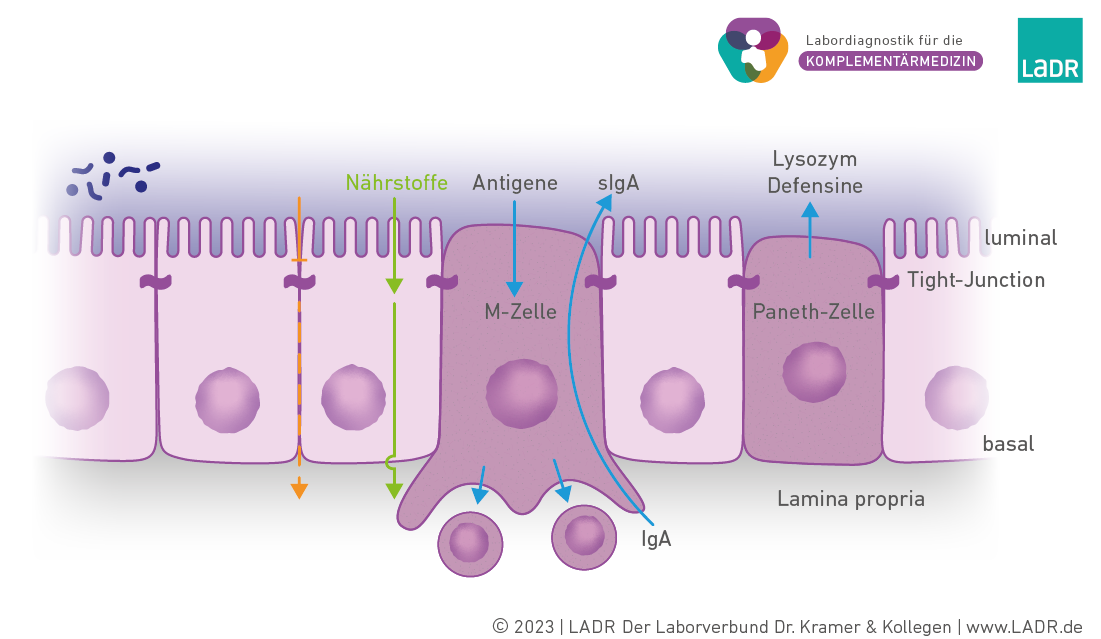

Die physiologische Darmbarriere verhindert das parazelluläre Eindringen von Fremdstoffen, hieran sind vor allem die Tight-Junctions beteiligt. Nährstoffe werden über spezielle Transporter (transzellulär, selektiv) aufgenommen. M-Zellen führen Antigene den Immunzellen der Lamina propria zu. Panethzellen, die in der Tiefe der Krypten des Darmepithels vorkommen, geben antibakteriell wirkend Lysozym und Defensine an das Darmlumen ab.
Die Darmbarriere als dynamische Struktur
Die Darmbarriere ist kein starres Gebilde, sondern eine dynamische Struktur, die auf interne und externe Reize reagiert. Dementsprechend können ihre Eigenschaften durch unsere Lebensweise (beispielsweise Ernährung, Bewegung, Arzneimittelkonsum) sowie den Kontakt zu Pathogenen beeinflusst werden (2, 7, 8, 9). Abhängig von der aufgenommenen Nahrung und der Zusammensetzung des Mikrobioms synthetisieren die einzelnen Bakterien unterschiedliche, positiv oder negativ wirkende Metabolite. Das aus Ballaststoffen generierte Butyrat, eine kurzkettige Fettsäure (short chain fatty acids, SCFA) beispielsweise dient den Epithelzellen als Energiequelle und in Laborversuchen konnte gezeigt werden, dass es unter anderem auch die Schleimproduktion fördert (4, 9). Die Aufnahme von Flavonoiden hat ebenfalls einen positiven Effekt auf die Darmbarriere (8).
Fett- und zuckerreiche Ernährung hingegen bewirkt im Tiermodell die verringerte Expression von Tight-Junction-Proteinen und damit eine erhöhte Durchlässigkeit (2, 10). Des Weiteren fördert sie den Transport von bakteriellen Lipopolysacchariden (LPS) durch die Epithelzellen. Dies löst über die Aktivierung von Toll-Like-Rezeptoren (TLR) auf den Zellen des angeborenen Immunsystems Entzündungsreaktionen aus. Durch freigesetzte Zytokine wie Interferon-gamma (IFNg) wird die Permeabilität weiter erhöht (1). Auch Medikamente wie nicht-steroidale Entzündungshemmer (NSAIDs) stehen im Verdacht, die Epithelschicht zu schädigen (8), andere Arzneimittel wiederum können das Mikrobiom negativ beeinflussen.
Gestörte Darmpermeabilität
Die pathologische Manifestation einer erhöhten Darmpermeabilität wird als Leaky Gut Syndrom (LGS, durchlässiger Darm) bezeichnet. Neben der verstärkten Translokation an Metaboliten, z. B. Calprotectin und Alpha-1-Antitrypsin, in das Darmlumen kommt es vor allem zum Eindringen größerer Moleküle wie bakterieller Toxine und LPS bis hin zu kompletten Bakterien in den Subepithelialraum und das Blut (2, 10). Die dadurch ausgelösten Entzündungsreaktionen schädigen die Darmbarriere zusätzlich. Betroffene können unter Durchfall, Blähungen und Nahrungsmittelunverträglichkeiten leiden. Es besteht der Verdacht, dass Autoimmunerkrankungen wie Typ-1 Diabetes, Multiple Sklerose oder Rheumatoide Arthritis mit einer gestörten Darmbarriere in Verbindung stehen könnten (7).
Permeabilitätsstörungen
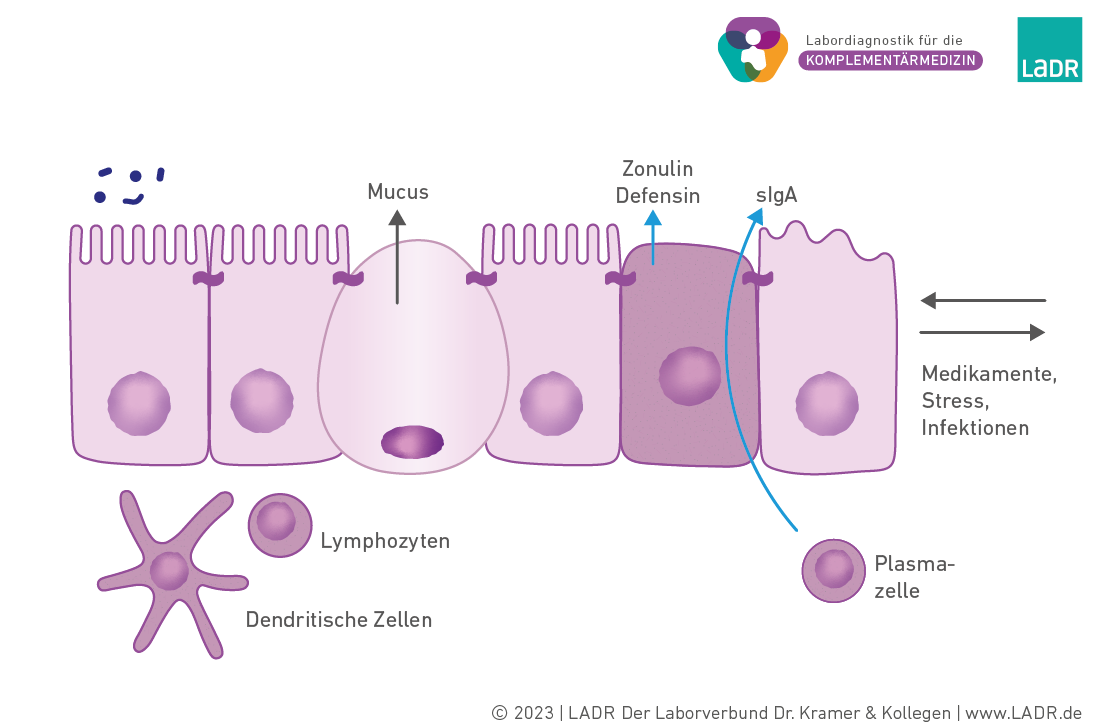

Physiologische Darmbarriere. Hier sind ausreichend Mucine vorhanden, das physiologische Mikrobiom synthetisiert kurzkettige Fettsäuren (Propionat, Butyrat), die Nähr- und Signalstoffe für die Darmepithelzellen sind. Messbare Parameter wie Zonulin und Defensine werden an das Lumen des Darms abgegeben (siehe auch unten im Text).
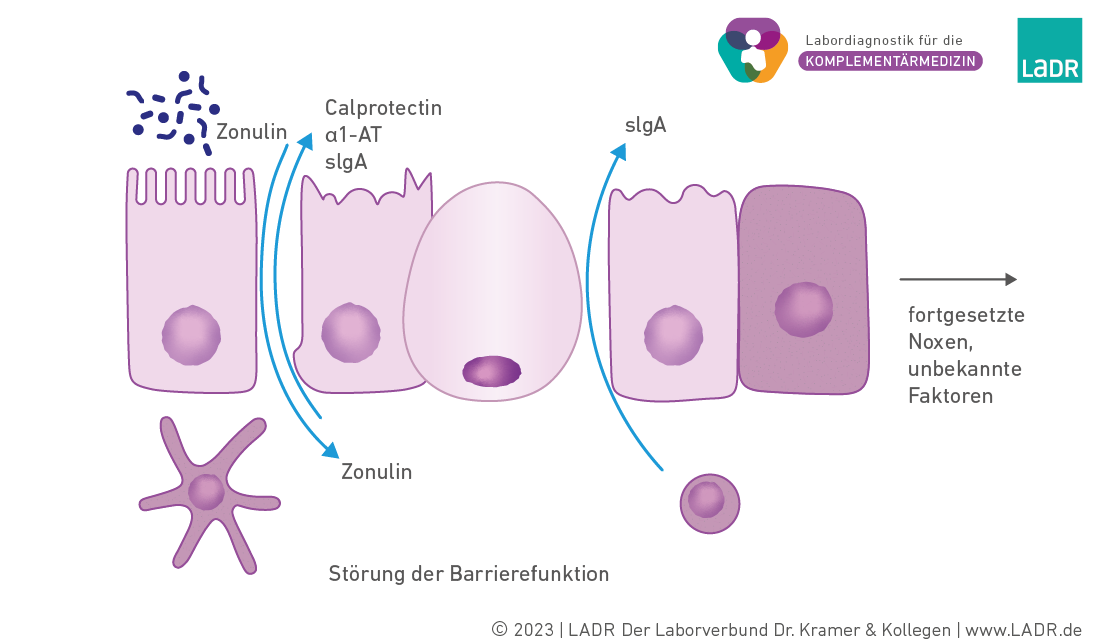

Durch verschiedene Faktoren kann es zu Störungen der Darmbarriere kommen. Hierzu zählen exogene (z. B. Medikamente, Alkohol) und endogene (z. B. Zusammensetzung des Mikrobioms, sIgA, Dicke und Zusammensetzung der Mucinschicht). In der Summe kann es zu Veränderungen in der Zusammensetzung des Mikrobioms, zu einer vermehrten Degradation der Mucinschicht und zu einer Störung der Integrität der Epithelschicht kommen. Dieser Vorgang ist reversibel und verläuft möglicherweise vielfach und unbemerkt ab.
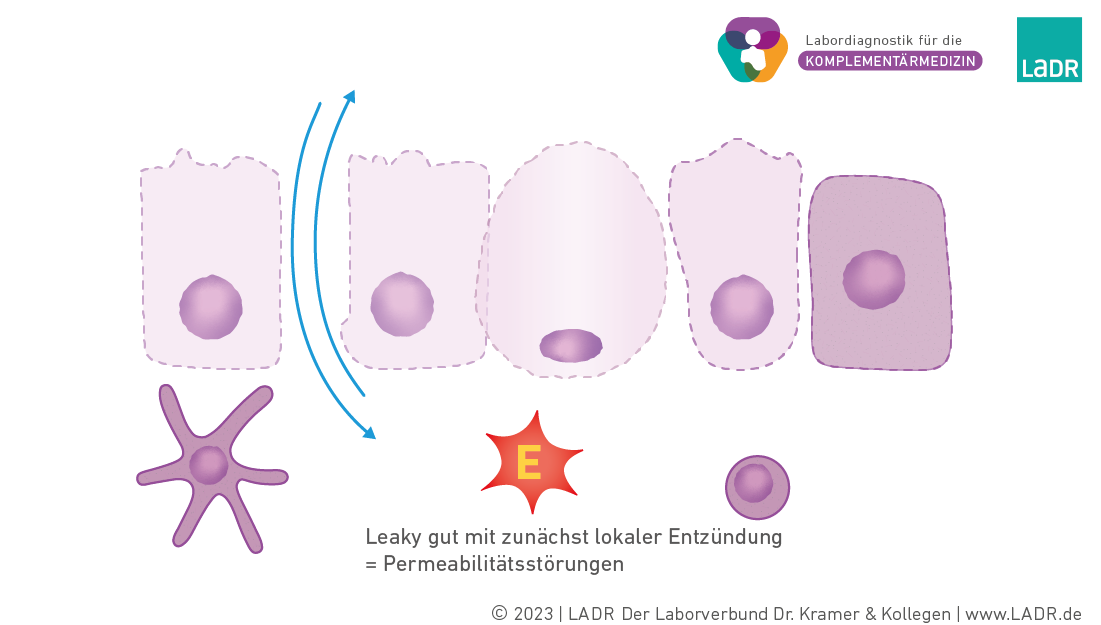

Durch eine fortgesetzte Exposition mit schädlichen exogenen Faktoren und der zunehmenden Schädigung der Schleimhaut kommt es zum Zustand des Leaky gut. Durch den Wegfall der Barrierefunktion können Stoffe die Darmepithelschicht ungehindert passieren.
Diagnostische Marker einer gestörten Barrierefunktion des Darmepithels: Laborchemische Parameter
Zur Bestimmung des Leaky Gut Syndrom können unterschiedliche Laborparameter aus Serum oder Stuhl untersucht werden:
Zonulin ist das humane Analogon des bakteriellen Zonula Occludens Toxin (Zot) und ein Vorläuferprotein von Haptoglobulin-2. Es ist das einzige bisher bekannte humane Protein, das an der Regulation der Tight-Junctions entscheidend beteiligt ist (1, 3, 11). Nach Kontakt mit größeren Bakterienmengen, aber auch mit Gliadin (Bestandteil von Gluten) wird es verstärkt von Epithelzellen ausgeschüttet. Durch Aktivierung spezifischer Rezeptoren (EGFR) löst es Veränderungen im Aktin-Zytoskelett aus, die zu einer vermehrten Durchlässigkeit der TJs (Tight-Junctions) führen. Obwohl ein erhöhter Zonulin-Wert im Blut nicht generell mit pathologischen Prozessen in Zusammenhang steht, kann er einen Hinweis auf eine Dysbiose oder funktionelle Störungen in der Darmbarriere liefern und scheint mit einigen Autoimmunerkrankungen wie Zöliakie und Typ I Diabetes assoziiert zu sein (1).
Calprotectin ist ein Calcium- und Zink-bindendes Protein (Dimer aus Calgranulin A und B), das vor allem von neutrophilen Granulozyten nach deren Aktivierung ausgeschüttet wird (8, 12). Der Nachweis im Stuhl zeigt eine zumeist entzündungsbedingte Aktivierung dieser intestinalen Immunzellen an, wobei die Menge an Calprotectin mit dem Entzündungsgrad korreliert.
In der Schleimschicht gebundene sekretorische IgAs (sIgAs) verhindern das Anheften und Eindringen von pathogenen Keimen und Partikeln (6). Sie werden von den Plasmazellen der Lamina propria sezerniert und mittels Transzytose durch die Epithelzellen transportiert. Die Produktion erfolgt kontinuierlich, da auch kommensale Mikroorganismen die Plasmazellen aktivieren können. Erhöhte sIgA-Werte im Stuhl deuten auf eine Entzündung hin, ein Mangel kann mit einen Immundefekt assoziiert sein.
Der Serin-Protease-Inhibitor Alpha-1-Antitrypsin (AAT) wird hauptsächlich von Leberzellen, aber auch in geringen Mengen von Makrophagen, Enterozyten und Panethzellen produziert (3). AAT ist ein Akute-Phase-Protein und zirkuliert im Blut, um im Verlauf von Entzündungsreaktionen körpereigene Proteine gegen Abbau zu schützen. Im Rahmen einer gestörten Darmbarriere tritt es verstärkt ins Darmlumen über (enteraler Proteinverlust), sodass der Nachweis im Stuhl als Biomarker dienen kann. Da die Serumspiegel allerdings großen Schwankungen unterliegen, ist die Bestimmung von fäkalem AAT nur in Kombination mit anderen hier genannten Untersuchungsparametern, und ggf. CRP, aussagekräftig.
Die kationischen Beta-Defensine gehören zur Gruppe der antimikrobiell wirksamen Peptide (AMP) des angeborenen Immunsystems und werden vor allem von Epithelzellen und Neutrophilen ins Darmlumen sezerniert (13). Sie binden an die negativ geladenen bakteriellen Membranen und formen mit ihrem hydrophoben Anteil transmembrane Kanäle. Durch diese gelangen weitere Peptide ins Zellinnere, stören die zellulären Funktionen und verursachen so den Tod der Mikroorganismen. Erhöhte Beta-Defensin-Werte im Stuhl können ein Anzeichen für Entzündungen im Darm und/oder eine verstärkte Besiedelung mit pathogenen Keimen sein.
| Parameter | Material |
|---|---|
| Zonulin | Stuhl, Serum, |
| Calprotectin | Stuhl |
| sekretorisches IgA (sIgA) | Stuhl |
| Alpha-1-Antitrypsin | Stuhl, auch Serum möglich |
| Beta-Defensine | Stuhl |
-
Analysen
-
Downloads
-
Konsiliarnetzwerk














































