Wofür genau braucht man Kreatin?
https://www.internisten-im-netz.de/krankheiten/metabolisches-syndrom/symptome-auswirkungen.html abgerufen am 22.09.2022
Metabolisches Syndrom - Den Entwicklungsprozess erkennen und rechtzeitig gegensteuern
Das Metabolische Syndrom ist definiert als gemeinsames Auftreten mehrerer Erkrankungen oder Symptome, die die Wahrscheinlichkeit für kardiovaskuläre Erkrankungen stark erhöhen. Vor allem Übergewicht und Bluthochdruck sowie Störungen im Fett- oder Glucosestoffwechsel gelten als Risikofaktoren. Da sie durch die westliche Lebensweise mit wenig körperlicher Bewegung und ungesunder Ernährung begünstigt werden, spricht man häufig auch von einem Metabolischen- oder Wohlstands-Syndrom. Nach den Kriterien der Internationalen Diabetes Föderation liegt ein Metabolische Syndrom vor, wenn der Taillenumfang bei Männern größer als 94 Zentimeter bzw. bei Frauen größer als 80 Zentimeter ist und mindestens zwei weitere Risikofaktoren vorhanden sind (1). In Deutschland trifft dies auf etwa 30-35 Prozent der Bevölkerung zu, vor allem bei über 60-Jährigen ist der Anteil hoch.
Jeder einzelne Risikofaktor kann die Blutgefäße schädigen und so Herz-Kreislauf-Erkrankungen verursachen, gemeinsam gelten sie auch als tödliches Quartett. Des Weiteren steigert das Metabolische Syndrom die Wahrscheinlichkeit für Typ-2-Diabetes. Betroffene haben häufig anfangs kaum Beschwerden, deshalb wird Übergewichtigen eine regelmäßige Kontrolle der Blutparameter empfohlen.
Das tödliche Quartett des Metabolischen Syndroms
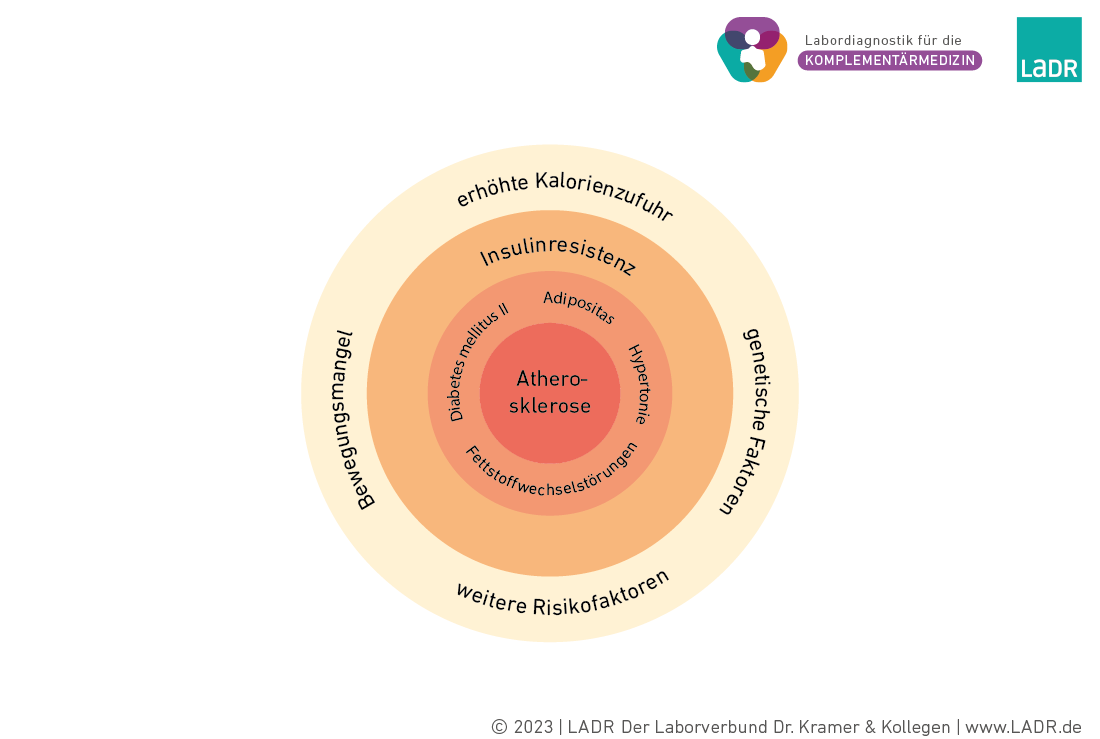

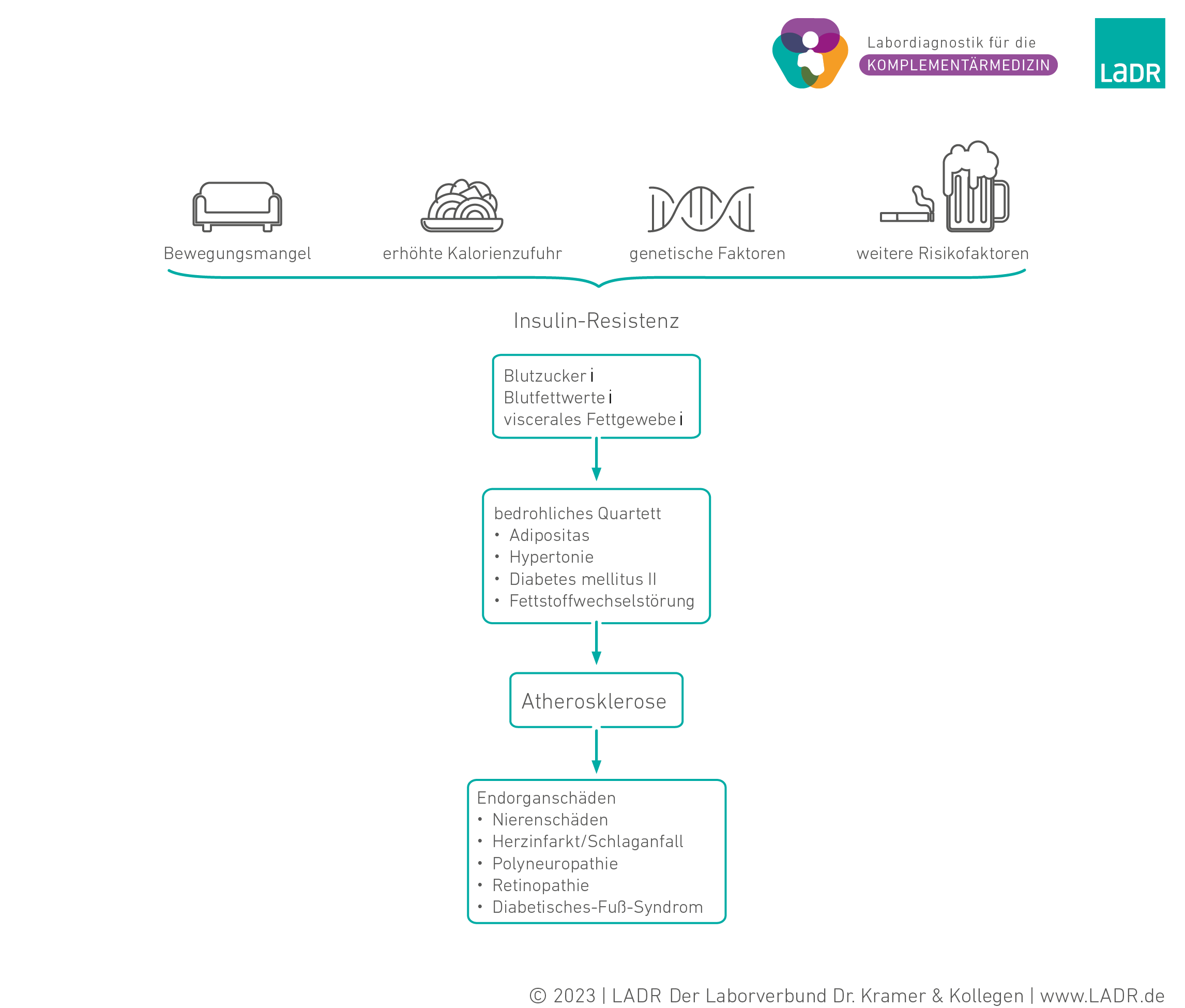
Dem Vollbild eines Metabolischen Syndroms geht eine lange Entwicklung voraus. Dabei bilden Bewegungsmangel, erhöhte Kalorienzufuhr, genetische Komponenten und weitere Risikofaktoren die Rahmenbedingungen, unter denen sich, meist unbemerkt, eine Insulinresistenz ausbildet. Pathophysiologisch steht die Insulinresistenz und die damit verbundene kompensatorische Hyperinsulinämie am Anfang und im Zentrum der voranschreitenden Entwicklung eines Metabolischen Syndroms.
Die frühen organischen Veränderungen wie die ektope Fetteinlagerung in Leber und Muskulatur, die Entwicklung eines Diabetes mellitus Typ II oder Fettstoffwechselstörungen verlaufen über einen langen Zeitraum schmerz- und beschwerdefrei, legen aber bereits den Grundstein für spätere, meist irreversible Störungen der Leber, der Niere und des Gefäßsystems.

Metabolisches Syndrom: Parameter in Zusammenhang mit dem Fettstoffwechsel
Cholesterin ist essentiell für den Aufbau von Zellmembranen und die Bildung von Steroidhormonen sowie Gallensäuren. Es wird entweder im Darm aus der Nahrung aufgenommen oder in der Leber synthetisiert und mithilfe unterschiedlicher Transportvesikel über das Blut verteilt. In Form von Low Density Lipoprotein (LDL) Vesikeln gelangt das Cholesterin zu allen Körperzellen. Erhöhte Mengen im Blut können allerdings eine Atherosklerose (degenerative Veränderung der Arterienwand) und nachfolgend kardiovaskulären Erkrankungen verursachen. Überschüssiges Cholesterin aus den Gefäßwänden und Gewebe wird von High Density Lipoprotein (HDL) Vesikeln zurück in die Leber transportiert, deshalb gelten diese als „gutes“ Cholesterin. Zur Risikoeinschätzung wird der LDL/HDL Quotient bestimmt.
Bei Triglyceriden handelt es sich um Fettsäuren, die mit Glycerin verknüpft sind und in dieser Form als Energiespeicher im Fettgewebe dienen. Sie werden im Rahmen einer Blutfettmessung bestimmt, erhöhte Blutwerte gehen mit einem gesteigerten Risiko für kardiovaskuläre Erkrankungen einher.
Lipoprotein (a) ist ein LDL-ähnliches Transportvesikel für Cholesterin, dessen Menge genetisch determiniert ist und nicht durch die Ernährung beeinflusst werden kann. Auch hier verstärken hohe Konzentrationen im Blut die Gefahr für eine Herz-Kreislauf-Erkrankung.
Das C-reaktive Protein (CRP) ist ein Akute-Phase-Protein, dessen erhöhte Werte in diesem Kontext auf eine chronische systemische Entzündung hinweisen, wie sie einer Atherosklerose zugrunde liegt. Es dient deshalb auch als Risikoindikator für das Metabolische Syndrom. Selbst in symptomfreien Personen können mithilfe einer hochsensitiven Methode (hs-CRP Analyse) geringe Erhöhungen der CRP-Spiegel im Blut detektiert werden.
Homocystein ist eine nicht proteinogene Aminosäure, die als Zwischenprodukt beim Abbau der Aminosäure Methionin entsteht. Erhöhte Mengen können die Endothelzellen der Gefäße schädigen und gelten dementsprechend als Risikofaktor für die Entwicklung einer Atherosklerose.
Bei Adiponectin handelt es sich um ein Gewebshormon, das in den Fettzellen gebildet wird und an der Regulation des Hungergefühls beteiligt ist. Der Plasmaspiegel korreliert invers mit der Anzahl der Fettzellen, das heißt, übergewichtige Personen haben niedrige Blutwerte. Eine verminderte Adiponectin-Konzentration scheint für eine gesteigerte Insulinresistenz mitverantwortlich zu sein, was die Entwicklung eines Metabolischen Syndroms initiiert bzw. verstärkt. Adiponectin in physiologicher Konzentration besitzt dagegen antiatherosklerotische Eigenschaften und aktuelle Studien zeigen, dass geringe Mengen im Blut mit einer schlechten Prognose bei kardiovaskulären Erkrankungen einhergehen.
Parameter im Zusammenhang mit dem Kohlenhydratstoffwechsel
Das Monosaccharid Glucose ist die wichtigste Energiequelle für unseren Körper. Er wird nach der Verdauung von Di- und Polysacchariden von den Zellen des Dünndarms aufgenommen und gelöst im Blut zu allen Organen transportiert. Insulin reguliert die Aufnahme von Glucose in die Zellen (Muskulatur und Fettgewebe) sowie verschiedene organspezifische Stoffwechselwege. Bei hohen Glucose-Mengen im Blut bewirkt Insulin außerdem die Bildung des Glucosesspeichers Glykogen in Leber- und Muskelzellen.
Laborchemisch könnten sowohl Insulin als auch das Proinsulin (Proinsulin, intakt) bestimmt werden. Hierbei handelt es sich um die Vorstufe des Insulins. Physiologisch wird das Proinsulin noch in den beta-Pankreaszellen unter Abspaltung des C-Peptids zu Insulin gespalten, beide Komponenten werden dann sekretiert und sind im Blut nachweisbar. Wenn die Sekretion des Insulins steigt, z.B. bei beginnender bzw. bestehender Insulin-Resistenz, wird zunehmend auch Proinsulin sekretiert. Proinsulin gilt als früher und spezifischer Marker einer Dysfunktion der beta- Pankreaszellen. Die Bestimmung der Parameter erfolgt aufgrund der geringen Halbwertzeit aus gefrorenem Serum.
Langfristig erhöhte Glucose-Konzentrationen können die Blutgefäße schädigen und dadurch kardiovaskuläre Erkrankungen verursachen. Mit zunehmendem Alter ist hierfür in den meisten Fällen nicht nur eine verringerte Insulin-Produktion durch die Beta-Zellen der Bauchspeicheldrüse verantwortlich, sondern vor allem eine reduzierte Reaktion der Körperzellen auf das zirkulierende Insulin (Insulin-Resistenz). Der Diabetes mellitus Typ 2 beruht auf einer abnehmenden Anzahl an Insulin-Rezeptoren auf den Oberflächen, wodurch die Wirkung des insulins, insbesondere die gesteigerte Aufnahme der Glucose in Fett- und Muskelzellen, ausbleibt. Mithilfe der Berechnung des HOMA-Index aus den Insulin- und Glucose-Werten nach 12-stündiger Nahrungskarenz kann das Ausmaß der Insulin-Resistenz abgeschätzt werden.
Die Beurteilung der Langzeit-Glucose-Konzentration erfolgt über die Bestimmung des HbA1c. Wenn Glucose in hohen Konzentrationen im Blut vorkommt, bindet die Glucose unspezifisch an Proteinreste (Glykierung). Diese Bindung erfolgt nicht-enzymatisch und kann alle im Blut, im Interstitium und intrazellulär lokalisierte Proteine betreffen. Auch das Hämoglobin-Molekül besteht aus Polypeptidketten und wird glykiert. Da dieser Prozess nicht wieder rückgängig gemacht werden kann und weil Erythrozyten eine durchschnittliche Lebensdauer von ca. 120 Tagen haben, lässt sich durch die Bestimmung des glykierten Hämoglobins (HbA1c) die Glukose-Konzentrationen der vergangenen 4-12 Wochen beurteilen und die Glukose-Werte der Blutmessungen einordnen.
Metabolisches Syndrom: Parameter zur Beurteilung der Organfunktion
Organfunktion: Leber
Der ungesunde Lebensstil in den Industrienationen führt häufig zu einer NAFLD (Nicht- alkoholassoziierte Fettleber-Erkrankung), wobei es zunächst zu einer übermäßigen Einlagerung von Fetten in die Leber kommt. Langfristig kann dies eine entzündliche Reaktion der Leber (Steatohepatitis) hervorrufen, gefolgt vom einer Fibrose bzw. Zirrhose oder auch, selten, dem Auftreten von Tumoren. Hinweise auf eine bereits beginnende Leberfunktionsstörung können nachfolgende Parameter liefern:
Das Enzym GOT (Glutamat-Oxalacetat-Transaminase, Synonym: Aspartat-Aminotransferase AST) wird bei der Verwertung von Glucose im Energiestoffwechsel der Zellen benötigt. In Kombination mit der Bestimmung von GPT (Glutamat-Pyruvat-Transaminase, Synonym: Alanin-Aminotransferase ALT), lassen sich Rückschlüsse auf eine Schädigung der Leberzellen schließen. Die Bestimmung des sensitiven Biomarkers gamma-Glutamyltransferase (GGT) kann die Analytik sinnvoll ergänzen.
Organfunktion: Niere
Albumin ist ein wichtiges, von der Leber synthetisiertes Serumprotein. Es dient als Transportprotein für überwiegend lipophile Moleküle. Die Aufrechterhaltung des kolloidosmotischen Drucks, das heißt der Flüssigkeitsverteilung zwischen Gefäßen und Gewebe, und die Stabilisierung des pH-Wert des Blutes sind ebenfalls wichtige Funktionen des Serumproteins. Verringerte Werte im Blut können auf eine (fortgeschrittene) Leberfunktionsstörung oder auf einen renalen Verlust hindeuten. Lässt sich hingegen Albumin im Urin nachweisen, dann besteht eher der Verdacht auf eine Nierenschädigung.
Ein weiterer Parameter für die Nierenfunktion ist Creatinin (auch: Kreatinin), ein Abbauprodukt des Stoffes Creatin. Es wird über die Nieren ausgeschieden, wobei die Menge vom Alter und der Muskelmasse abhängt. Da sich eine beginnende Niereninsuffizienz erst spät in den Plasmaspiegeln bemerkbar macht, kann bei einem Verdacht über 24 Stunden der Urin gesammelt und in Kombination mit den Creatinin-Konzentrationen im Blut und Urin die Clearance (Eliminierung aus dem Blut) berechnet. Alternativ kann zur Bestimmung der Nierenfunktion auch das Cystatin C im Serum bestimmt werden. Dieser Parameter ist unabhängg von der Muskelmasse und wird ausschließlich renal eliminiert.
Auch die Messung von Harnsäure im Blut kann einen Hinweis auf Nierenerkrankungen liefern. Harnsäure entsteht als Abbauprodukt von Nukleinsäuren und wird zu 75% über die Niere ausgeschieden. Ergänzend kann die Bestimmung von Harnstoff, dem Abbauprodukt von Aminosäuren, sinnvoll sein.
Der Elektrolyt Kalium spielt eine wichtige Rolle bei der Regulation des Blutdrucks und der Aufrechterhaltung des Ruhepotenzials von Nerven- und Muskelzellen. Zu hohe aber auch zu niedrige Kaliumkonzentrationen im Blut beeinträchtigen die Herzmuskelfunktion und können lebensbedrohlich sein.
Calcium ist nicht nur wichtig für die Stabilität der Knochen, sondern auch essentiell für viele Stoffwechselvorgänge, die Muskelkontraktion sowie für die Blutgerinnung. Eine zu hohe Calciumzufuhr stellt allerdings ein Risiko für Herz-Kreislauf-Erkrankungen dar. Weil ca. die Hälfte des Calciums im Blut an Proteine, vornehmlich an Albumin, gebunden ist. In der Betrachutng des Messergebnisses kann es sinvoll sein, den gemessenen Calcium-Wert auf die Gesamtprotein-Menge oder auf die Albumin-Menge zu beziehen. (‚ionisiertes Calium‘ wird auf das Gesamt-Eiweiß bezogen, ‚korrigiertes Calcium‘ wird auf die Albumin-Menge bezogen)
Laborparameter zur Beurteilung des Risikos für die Entstehung eines Metabolischen Syndroms
| Parameter | Material |
|---|---|
| Cholesterin, gesamt | Serum |
| LDL-Cholesterin | Serum |
| HDL-Cholesterin | Serum |
| Triglyceride | Serum |
| Lipoprotein(a) | Serum |
| C-reaktives Protein (CRP) | Serum |
| hsCRP | Serum |
| Homocystein | Blut, EDTA-Plasma, Serum |
| Adiponectin | Serum |
| Insulin | Serum |
| Proinsulin, intaktes | Serum |
| HOMA-Index | Serum |
| HbA1C (Hämoglobin A1C) | EDTA-Blut |
| GOT (Glutamat-Oxalacetat-Transaminase) | Serum |
| GPT (Glutamat-Pyruvat-Transaminase) | Serum |
| Gamma-GT | Serum |
| Albumin | Serum |
| Cystatin C | Serum |
| Harnsäure | Serum |
| Harnstoff | Serum |
| Kalium (K) | Serum |
| Calcium (Ca) | Serum |
-
Analysen
-
Downloads
-
Konsiliarnetzwerk















































