Bestellen Sie entsprechendes Material zur Blutkulturdiagnostik bei unserem Partner Intermed.
Bourbeau PP et al.; Routine incubation of BacT/ALAET FA and FN blood culture bottles for more than 3 days may not be necessary 2005; 43:2506-2509.
Dargère S et al.; Contaminants in blood cultures: importance, implications, interpretation and prevention; Clin Microbiol Infect 2018;24:964
Doern GV et al.; A Comprehensive Update on the problem of blood culture contamination and a discussion of methods for addressing the problem; Clin Microbiol Rev. 2019; 33:e00009-19.
García-Vázquez E et al.; When is coagulase-negative Staphylococcus bacteraemia clinically significant? Scand J Infect Dis 2013; 45:664.
Lamy B; Reprint of: Blood culture time-to-positivity: making use of the hidden information; Clin Microbiol Infect 2019; 25:399-402
Lamy B et al.; How to optimize the use of blood cultures for the diagnosis of bloodstream infections? A State-of-the Art; Front Microbiol. 2016; 7: 697
Seifert, H et al. MIQ 03a/b: Blutkulturdiagnostik - Sepsis, Endokarditis, Katheterinfektionen (Teil I&II) 2007
Blutkulturdiagnostik: Tipps für den klinischen Alltag
Die Blutkulturdiagnostik ist eine der wesentlichen Nachweis-Methoden in der Medizin: etwa bei einer Sepsis, einem septischen Schock oder einer Endokarditis; ebenso, wenn bei schwerer Organdysfunktion der Verdacht auf eine systemische Beteiligung besteht, und nicht zuletzt bei Fieber unklarer Genese, insbesondere bei immunsupprimierten Patient*innen.
Entnahmezeitpunkte von Blutkulturen
Blutkulturen sollten unmittelbar bei Verdacht oder Auftreten einer auf eine systemische Infektion hinweisenden Symptomatik, z.B. Schüttelfrost, abgenommen werden – und zwar unabhängig von der Körpertemperatur.
Dazu sollten die Proben zur mikrobiologischen Diagnostik unbedingt vor der ersten Dosis einer antiinfektiven Therapie entnommen werden, da diese die Vermehrung der Mikroorganismen nachhaltig einschränkt. Dies gilt insbesondere bei differentialdiagnostischem Verdacht auf eine Endokarditits oder Spondylodiszitis.
Entnahmetechnik
Generell ist bei der Blutentnahme ein aseptisches Vorgehen erforderlich, zu dem eine hygienische Händedesinfektion, die Desinfektion der Haut im Bereich der Punktionsstelle und die nachfolgende Desinfektion der Gummimembran der Blutkulturflasche mit einem alkoholhaltigen Desinfektionsmittel unter Einhaltung der Einwirkzeit gehören.
Die Entnahme aus intravaskulären Kathetern sowie Portsystemen sollte nur in absoluten Ausnahmen erfolgen, da deutlich höhere Kontaminationsraten auftreten. Die Flaschen sollten direkt nach der Punktion über den sterilen Adapter befüllt werden. Dieses Vorgehen reduziert die Kontaminationsgefahr und das Nadelstichrisiko. Eine zusätzliche Belüftung der Flaschen ist nicht erforderlich und zu vermeiden.
Blutkulturdiagnostik – benötigtes Material
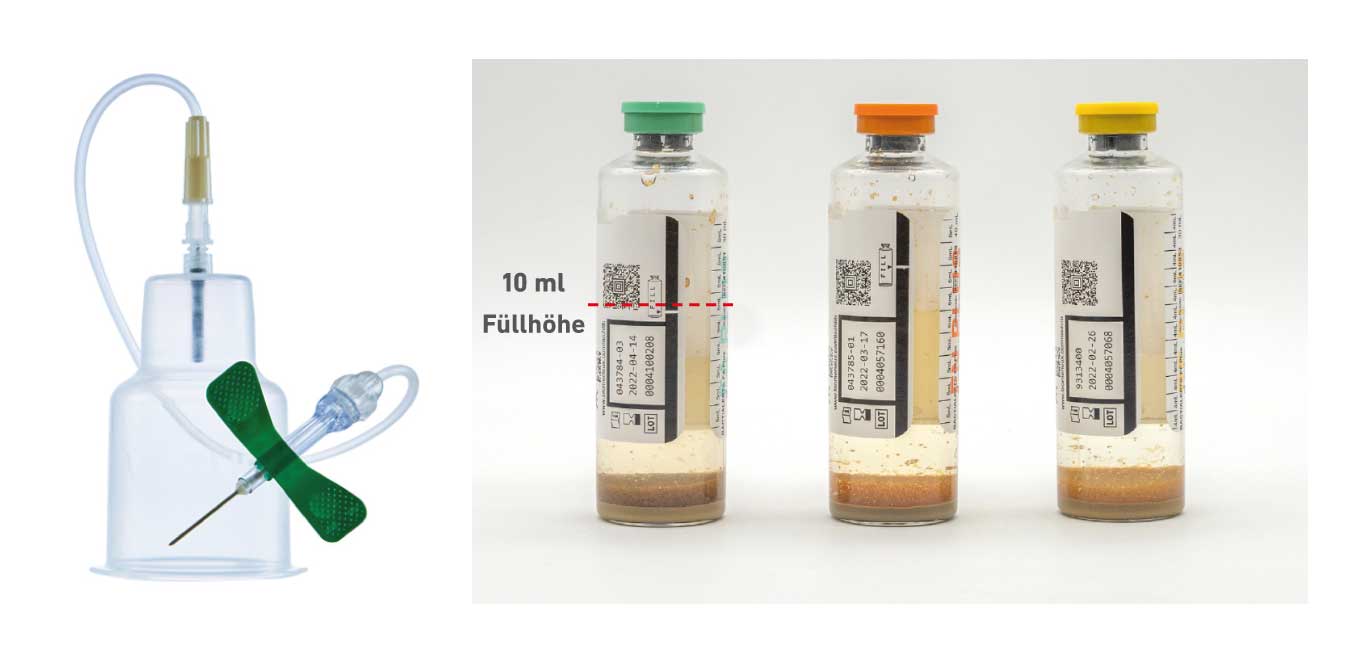

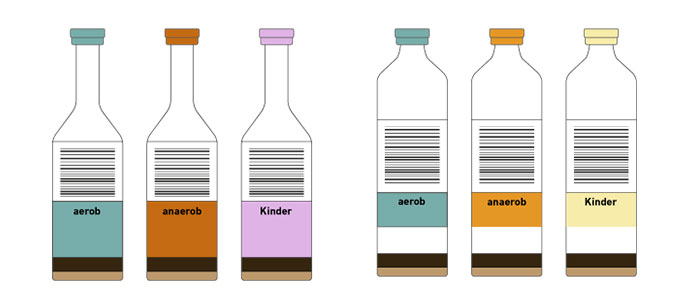
v.l.n.r.: Entnahmebesteck; aerobe (grün) bzw. anaerobe (orange) Blutkulturflasche, Blutkulturflasche für Kinder (gelb)
Blutvolumen und Anzahl der Blutkulturen
Bei Erwachsenen werden jeweils 10 ml in eine aerobe und eine anaerobe Blutkulturflasche injiziert, die zusammen ein Blutkulturset ergeben.
Bei Kindern über 20 kg Körpergewicht werden jeweils 5 ml Blut in eine aerobe und eine anaerobe Blutkulturflasche inokuliert.
Bei Kindern unter 20 kg Körpergewicht sollten 1–10 ml Blut entnommen werden, das jeweils hälftig auf eine aerobe und eine anaerobe Blutkulturflasche verteilt wird.
Bei Früh- und Neugeboren reicht i.d.R. die Beimpfung einer speziellen Blutkulturflasche für Kinder mit ≥ 0,5 ml Blut.
Zur Steigerung der Sensitivität bei der Blutkulturdiagnostik sollten bei Erwachsenen und Jugendlichen 2–4 Blutkulturen gewonnen werden.
Die getrennte Punktion pro Blutkultur ist hierbei zu bevorzugen, um Kontaminationen zu reduzieren und zu identifizieren. Die Sensitivität, eine Bakteriämie zu diagnostizieren, wird bei einem Blutkulturset mit 73 % angegeben, bei zwei Sets mit 94 % und bei drei Sets mit 97 %.
Hat man den Verdacht auf eine Katheterinfektion, empfiehlt sich die parallele Entnahme peripher und über den Katheter abgenommener Blutkulturen.
Administrative Angaben für den Auftrag
Der Auftrag sollte Informationen wie:
- Name und Vorname,
- Geburtsdatum,
- Geschlecht,
- Klinik + Station,
- Datum und Uhrzeit der Blutkulturentnahme,
- Entnahmeort,
- Grunderkrankungen,
- infektiologische Verdachtsdiagnose
- und ggf. Art der antimikrobiellen Vorbehandlung
enthalten, um Sie bestmöglich bei der Interpretation zu unterstützen.
Barcode richtig aufkleben
Transport und Lagerung
Blutkulturen sollten zeitnah (innerhalb von 2–4 h) ins Labor gebracht werden. Eine ggf. notwendige zwischenzeitliche Lagerung der Blutkulturflaschen erfolgt bei Zimmertemperatur (laut Hersteller max. 24 Stunden).
Fehlermöglichkeiten
Das Bakterienwachstum kann verhindert werden, wenn ein zu geringes Blutvolumen verwendet wurde (siehe oben) oder wenn Patient*innen mit antiinfektiven Substanzen vorbehandelt wurden.
Auf der anderen Seite können Kontaminationen bei der Blutkulturentnahme zum Wachstum von Keimen der Hautflora führen, die nicht ursächlich für die Blutstrominfektion sind. Das gilt insbesondere bei einmaligem Nachweis von Keimen der normalen Hautflora, wie z.B. Cutibakterien, Propionibakterien, Corynebakterien, Mikrokokken, Bacillus-Arten oder koagulasenegativen Staphylokokken.
So konnte in einer Studie von García-Vázquez et al. gezeigt werden, dass bei koagulasenegativen Staphylokokken erst eine Time-to-Positivity (= Inkubationszeit der Blutkultur, bis Wachstum in der Flasche detektiert wird) von weniger als 16 h mit einer wahrscheinlichen klinischen Bedeutung der Erreger assoziiert ist.
Blutkulturmedien und -systeme
Heutzutage werden überwiegend Geräte mit automatisierten Detektionssystemen eingesetzt, die zu einer verbesserten Sensitivität und einem beschleunigten Nachweis des Wachstums geführt haben. Die eingesetzten Blutkulturmedien ermöglichen das Wachstum nahezu aller anzüchtbaren aeroben und anaeroben humanpathogenen Bakterien.
Inkubationsdauer und Sonderfälle
Die Bebrütungsdauer bei automatisierten Blutkultursystemen beträgt i.d.R. 5–7 Tage. Auch bei Verdacht auf eine Endokarditis (HACEC-Erreger) ist keine längere Bebrütungszeit erforderlich. Nur in Ausnahmefällen können längere Bebrütungszeiten notwendig werden. So werden Blutkultursets bei Verdacht auf Brucellen 21 Tage und bei V.a. Schimmelpilze 30 Tage bebrütet.
Vorgehen bei positiven Blutkulturen
Wird eine Blutkultur vom Gerät als bewachsen gemeldet, werden ein Grampräparat, eine Subkultur und eine orientierende Empfindlichkeitsprüfung (Agardiffusionsverfahren und Bewertung nach EUCAST Version 3.0 von 2021) angefertigt.
Das Ergebnis des Grampräparates wird unverzüglich den behandelnden Ärzt*innen mitgeteilt, damit die kalkulierte Antibiotikatherapie ggf. angepasst werden kann.
Interpretation der Ergebnisse von GramPräparaten aus Blutkulturen
| Gram-Präparat | Häufige Erreger |
|---|---|
| Grampositive Haufenkokken | z.B. Staphylokokken |
| Grampositive Kettenkokken | z.B. Streptokokken, Enterokokken |
| Gramnegative Stäbchen | z.B. Enterobacterales (wie E. coli, Klebsiella spp., Enterobacter spp.), Pseudomonas spp., Acinetobacter spp. |
Eine Subkultur auf geeigneten Nährböden erlaubt i.d.R. schon nach wenigen Stunden (4–8 h) eine genaue Erregeridentifikation mittels Massenspektrometrie (MALDI-TOF). Mit vorläufigem Antibiogramm ermöglicht dies den behandelnden Ärzt*innen, ca. 6–8 h nach einem ersten Wachstumssignal eine optimierte und gezielte antiinfektive Therapie umzusetzen.
Orientierende „Schnellresistenzbestimmungen“ (nach EUCAST Zone diameter breakpoints for rapid antimicrobial susceptibility testing (RAT) directly from blood culture bottles/ Version 3.0 / 2021) sind z.Z. bei folgenden Erregern möglich und können mitgeteilt werden:
- Staphylococcus aureus,
- Streptococcus pneumoniae,
- Enterococcus faecalis und
- Enterococcus faecium,
- Escherichia coli,
- Klebsiella pneumoniae,
- Pseudomonas aeruginosa und
- Acinetobacter baumannii.
Von einer systemischen Infektion ist auszugehen bei Nachweis folgender Erreger in bereits einer Blutkultur:
- Staphylococcus aureus,
- Listeria monocytogenes,
- Haemophilus influenzae,
- Escherichia coli,
- Pseudomonas aeruginosa oder
- Brucellen.
Bei einem Nachweis von Staphylococcus aureus oder von Hefen in einer Blutkultur ist daran zu denken, dass 48-72 h nach Therapiebeginn eine Blutkulturkontrolle zur Planung der Therapiedauer empfohlen wird!
Bei Nachweis von Staphylococcus aureus wird zusätzlich zur Identifikation immer auch ein Antigen- oder PCR-Test zum Ausschluss/Nachweis von PBP-2a (modifiziertes Penicillin-bindendes Protein bzw. mecA-Gen ) durchgeführt, um frühzeitig eine Methicillinresistenz zu diagnostizieren und ggf. eine MRSA-spezifische Therapie zu beginnen.
Sonderfall: Diagnose einer Katheterinfektion
Bei Verdacht auf eine Katheter-assoziierte Bakteriämie kommen folgende Methoden zur Anwendung:
- Die Agar-Roll-Technik nach Maki, die (allerdings nur bei koagulasenegativen Staphylokokken) eine semiquantitative Bestimmung der koloniebildenden Einheiten (KBE) am Kathetersegment erlaubt. Hierzu wird das steril entnommene Kathetersegment ohne Transportmedium ungekühlt in einem sterilen Behältnis eingesandt. Bei Nachweis von ≥15 KBE kann man von einer klinisch relevanten Besiedelung ausgehen, sodass bei Vorliegen einer entsprechenden Symptomatik eine Katheterinfektion wahrscheinlich ist. Bei Erregern wie Staphylococcus aureus oder gramnegativen Bakterien können schon geringe Keimzahlen auf eine Katheterassoziierte Infektion hinweisen.
- Alternativ kann die Bestimmung der Differential Time-to-Positivity (DTP) zum Einsatz kommen. Hierzu wird je eine über den Katheter und peripher entnommene Blutkultur eingesandt und die Zeit bis zum Wachstumssignal verglichen. Weist die mit Katheterblut beimpfte Kultur eine mindestens zwei Stunden geringere Inkubationzeit auf, ist eine Katherassoziierte Blutstrominfektion wahrscheinlich.
Befundlaufzeit
Die durchschnittliche Befundlaufzeit teilt sich auf wie folgt: ca. 1/2 Tag von Entnahme bis zum Beginn der Inkubation, 1–3 Tage Bebrütungszeit bis zur Detektion des Wachstums, 1/2–2 Tage für die Identifikation und Resistenzbestimmung.
Befundinterpretation und -mitteilung
Rückschlüsse auf die mögliche klinische Relevanz einer Bakteriämie erlauben:
- die Art des Erregers (siehe oben),
- der mögliche Nachweis des gleichen Erregers in unterschiedlichen Blutkulturen und
- das Zeitintervall von Abnahme bis zum Erregernachweis
Als Teilbefund wird das Ergebnis des Grampräparates, der Erregeridentifikation sowie das Ergebnis einer vorläufigen wie endgültigen Empfindlichkeitsbestimmung jeweils unverzüglich mitgeteilt.
Prozesse und Bearbeitungszeiten der Blutkulturdiagnostik.
Ab Wachstumssignal: klassische Diagnostik (weiße Felder) bzw. beschleunigte Diagnostik (grüne Felder). Zwischenergebnisse (oranger Rahmen) werden dem Einsender übermittelt.
-
Analysen
-
Downloads
-
Konsiliarnetzwerk






































